题目内容
8.下列说法正确的是( )| A. | 由非金属元素形成的化合物一定不是离子化合物 | |
| B. | 含有金属元素的化合物一定是离子化合物 | |
| C. | 活泼金属与活泼非金属化合时,能形成离子键 | |
| D. | 第IA族和VIIA族原子化合时,一定生成离子键 |
分析 A.铵盐中均为非金属元素;
B.含有金属元素的化合物可能为共价化合物;
C.活泼金属易失去电子,活泼非金属易得到电子;
D.第IA族含H元素.
解答 解:A.由非金属元素形成的化合物可能为离子化合物,如铵盐,故A错误;
B.含有金属元素的化合物可能为共价化合物,如氯化铝为共价化合物,故B错误;
C.活泼金属易失去电子,活泼非金属易得到电子,则活泼金属与活泼非金属化合时,能形成离子键,故C正确;
D.第IA族含H元素,H与卤素原子化合以共价键结合,故D错误;
故选C.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意铵盐为特殊的离子化合物,题目难度不大.

练习册系列答案
 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案 互动课堂系列答案
互动课堂系列答案
相关题目
20.下列说法不正确的是( )
| A. | 可通过酸性高锰酸钾溶液来区别乙烷和乙炔 | |
| B. | 乙烯是石油裂解后的产物 | |
| C. | 石油的分馏、煤的干馏是物理变化,石油的裂解和裂化是化学变化 | |
| D. | 棉花、蛋白质、淀粉都是高分子化合物,都能发生水解反应 |
1. 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)上述反应是(填“是”或“不是”)可逆反应,在第5s时,NO的转化率为65%.用O2表示从0~2s内该反应的平均速率v=0.0015mol/(L•s).
(2)如图所示,表示NO2变化曲线的是b.
(3)能说明该反应已达到平衡状态的是bc(填序号).
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变.
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图所示,表示NO2变化曲线的是b.
(3)能说明该反应已达到平衡状态的是bc(填序号).
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变.
16.近年来,硫化铜矿的湿法冶炼已经取得很大的进展.现有一种催化氧化酸浸硫化铜矿的湿法冶炼法,其工艺流程如1图所示:

温度、固液比、反应时间、氯离子浓度都对铜的浸出率有较大的影响,下面是实验得出的这几种因素对铜的浸出率影响的变化曲线图(如图2-图5所示)
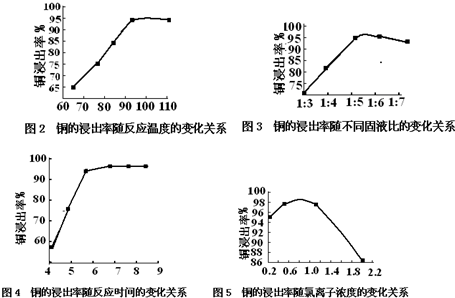
(1)根据实验以及工业生产的实际要求,从图2-图5中得出的最佳工艺条件为(从下表中选出序号)A.
(2)上述流程从溶液中得到纯净的FeSO4•7H2O晶体的操作是蒸发浓缩、冷却结晶、过滤、用冰水洗涤、用乙醇淋洗、干燥.用乙醇淋洗的目的是:由于乙醇易挥发,晶体容易干燥.
(3)副产品FeSO4•7H2O样品的纯度可用滴定法进行测定,实验步骤如下:
步骤1:称取5.800g绿矾产品,经溶解、定容等步骤准确配制250mL溶液.
步骤2:从上述容量瓶中量取25.00mL待测溶液于锥形瓶中,
步骤3:用硫酸酸化的0.0100mol/L KMnO4溶液滴定至终点,记录消耗KMnO4溶液体积
步骤4:重复步骤2、步骤3一至两次.
①步骤1中用到的玻璃仪器有:烧杯、玻璃棒、胶头滴管和250mL容量瓶,步骤2量取溶液所用仪器是酸式滴定管.
②写出步骤3反应的离子方程式5Fe2++MnO-4+8H+=5Fe3++Mn2++4H2O:
③数据处理:
计算上述样品中FeSO4•7H2O的质量分数为95.86%.
④不考虑操作误差,用上述方法测定的样品中FeSO4•7H2O的质量分数偏低(填偏低、偏高或无影响).

温度、固液比、反应时间、氯离子浓度都对铜的浸出率有较大的影响,下面是实验得出的这几种因素对铜的浸出率影响的变化曲线图(如图2-图5所示)

(1)根据实验以及工业生产的实际要求,从图2-图5中得出的最佳工艺条件为(从下表中选出序号)A.
| 反应温度/℃ | 固液比 | c(Cl-)/mol•L-1 | 反应时间/h | |
| A | 95 | 1:5.5 | 0.8 | 6 |
| B | 100 | 1:5.5 | 0.7 | 7 |
| C | 110 | 1:6 | 0.9 | 8 |
(3)副产品FeSO4•7H2O样品的纯度可用滴定法进行测定,实验步骤如下:
步骤1:称取5.800g绿矾产品,经溶解、定容等步骤准确配制250mL溶液.
步骤2:从上述容量瓶中量取25.00mL待测溶液于锥形瓶中,
步骤3:用硫酸酸化的0.0100mol/L KMnO4溶液滴定至终点,记录消耗KMnO4溶液体积
步骤4:重复步骤2、步骤3一至两次.
①步骤1中用到的玻璃仪器有:烧杯、玻璃棒、胶头滴管和250mL容量瓶,步骤2量取溶液所用仪器是酸式滴定管.
②写出步骤3反应的离子方程式5Fe2++MnO-4+8H+=5Fe3++Mn2++4H2O:
③数据处理:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00mL | 0.02 | 40.01 |
| 2 | 25.00mL | 0.70 | 40.71 |
| 3 | 25.00mL | 0.20 | 39.20 |
④不考虑操作误差,用上述方法测定的样品中FeSO4•7H2O的质量分数偏低(填偏低、偏高或无影响).
18.下列各组气态氢化物稳定性由强到弱的顺序排列的是( )
| A. | SiH4、PH3、H2S、HCl | B. | HF、HCl、HBr、HI | ||
| C. | PH3、H2S、HCl、HF | D. | NH3、PH3、AsH3、HF |

 A、B、C、D、E、F是中学中常见的物质,其转化关系如图所示(反应条件未标出),已知反应①是置换反应.
A、B、C、D、E、F是中学中常见的物质,其转化关系如图所示(反应条件未标出),已知反应①是置换反应. ,反应③的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
,反应③的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O. Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.