题目内容
4.孔雀石的主要成分为Cu2(OH)2CO3,还含少量铁的氧化物和硅的氧化物.以下是实验室以孔雀石为原料制备CuSO4•5H2O晶体的流程图:
(1)孔雀石研磨的目的是增大固体表面积,从而增大反应速率.浸泡孔雀石的试剂A若选用过量的稀硫酸,则产生的气体a是CO2(填化学式)、固体a是SiO2(填化学式).
(2)使用试剂B的目的是将溶液中的Fe2+转化为Fe3+,试剂B宜选用B(填选项序号).
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
相应的离子方程式:2FeSO4+H2SO4+H2O2=Fe2(SO4)3+2H2O 或 2Fe2++2H++H2O2=2Fe3++2H2O.
(3)试剂C的使用目的是调节溶液pH,使Fe3+转化为沉淀予以分离.试剂C宜选用D(填选项序号).
A.稀硫酸 B.NaOH溶液 C.氨水 D.CuO
相应的离子方程式CuO+2H+=Cu2++H2O.
(4)1mol氨气通过加热的Cu2(OH)2 CO3可以产生1.5mol金属铜,发生反应的化学方程式:3Cu2(OH)2CO3+4NH3 $\frac{\underline{\;\;△\;\;}}{\;}$6Cu+3CO2+9H2O+2N2.
分析 孔雀石经研磨后加过量的稀硫酸浸泡,Cu2(OH)2CO3和铁的氧化物会与硫酸反应,生成气体a为二氧化碳,固体a为不溶的二氧化硅,溶液a为铜和铁的硫酸盐溶液,溶液a中加入试剂B、C将溶液中的Fe2+转化为Fe3+,调节溶液pH,使Fe3+转化为沉淀予以分离,得沉淀C为氢氧化铁,溶液C为硫酸铜溶液.
(1)根据增大固体表面积,能增大反应速率.Cu2(OH)2CO3会与硫酸反应则产生CO2气体,SiO2不溶;
(2)双氧水不但能将溶液中的Fe2+转化为Fe3+,而且不引入新的杂质,其他试剂会引入杂质离子.根据Fe2+在酸性条件下与H2O2反应生成Fe3+和H2O,配平可得相应的化学反应方程式;
(3)CuO应该能与酸反应,增大溶液pH,使Fe3+完全转化为沉淀予以分离,而且不引入杂质;稀硫酸不反应,NaOH溶液和氨水会引入杂质;
(4)根据电子守恒可推知氨气应被还原为氮气,然后根据定量关系和质量守恒配平发生反应的化学方程式:3Cu2(OH)2CO3+4NH3 $\frac{\underline{\;\;△\;\;}}{\;}$6Cu+3CO2+9H2O+2 N2;
解答 解:孔雀石经研磨后加过量的稀硫酸浸泡,Cu2(OH)2CO3和铁的氧化物会与硫酸反应,生成气体a为二氧化碳,固体a为二氧化硅,溶液a为铜和铁的硫酸盐溶液,溶液a中加入试剂B、C将溶液中的Fe2+转化为Fe3+,调节溶液pH,使Fe3+转化为沉淀予以分离,得沉淀C为氢氧化铁,溶液C为硫酸铜溶液.
(1)孔雀石研磨的目的是 增大固体表面积,从而增大反应速率.Cu2(OH)2CO3会与硫酸反应则产生CO2气体,固体a是不溶的 SiO2,
故答案为:增大固体表面积,从而增大反应速率;CO2;SiO2;
(2)试剂B宜选用双氧水,因为双氧水不但能将溶液中的Fe2+转化为Fe3+,而且不引入新的杂质,其他试剂会引入杂质离子.根据Fe2+在酸性条件下与H2O2反应生成Fe3+和H2O,配平可得相应的化学反应方程式:2Fe2++2H++H2O2=2Fe3++2H2O或2FeSO4+H2SO4+H2O2=Fe2(SO4)3+2H2O,
故答案为:B;2FeSO4+H2SO4+H2O2=Fe2(SO4)3+2H2O 或 2Fe2++2H++H2O2=2Fe3++2H2O;
(3)试剂C应该能与酸反应,增大溶液pH,使Fe3+完全转化为沉淀予以分离,而且不引入杂质,故宜选用CuO,相应的离子方程式CuO+2H+=Cu2++H2O;稀硫酸不反应,NaOH溶液和氨水会引入杂质,故不适合,
故答案为:D;CuO+2H+=Cu2++H2O;
(4)1mol氨气通过加热的Cu2(OH)2CO3可以产生1.5mol金属铜,根据电子守恒可推知氨气应被还原为氮气,然后根据定量关系和质量守恒配平发生反应的化学方程式:3Cu2(OH)2CO3+4NH3 $\frac{\underline{\;\;△\;\;}}{\;}$6Cu+3CO2+9H2O+2 N2,
故答案为:3Cu2(OH)2CO3+4NH3 $\frac{\underline{\;\;△\;\;}}{\;}$6Cu+3CO2+9H2O+2N2;
点评 本题考查了铜及其重要化合物的性质、物质的制备、分离与提纯,有关Ksp的计算等问题,综合性较强,掌握基础是解题关键,题目难度中等.


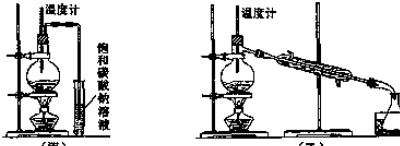
| A. | 第③步所需的主要玻璃仪器有:玻璃棒、烧杯、分液漏斗 | |
| B. | 第④步的离子反应方程式:H2O2+2I-+2H+=I2+2H2O | |
| C. | 第⑤步的CCl4可换成苯或酒精 | |
| D. | 该流程中分离出的碘可直接用作“加碘”食盐的碘添加剂 |
 “低碳循环”、如何降低大气中CO2的含量、有效地开发利用CO2,引起了全世界的普遍重视.
“低碳循环”、如何降低大气中CO2的含量、有效地开发利用CO2,引起了全世界的普遍重视.I. 用电弧法合成的储氢纳米碳管,可用如下氧化法提纯,请完成下述反应:
5 C+4 KMnO4+6 H2SO4→5CO2↑+4MnSO4+2K2SO4+6 H2O
II.某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H<0,得到如下数据:
| 实验组 | 温度/℃ | 起始量(mol) | 平衡量(mol) | 达到平衡所 需要时间/min | ||
| CO(g) | H2O(g) | CO2(g) | H2(g) | |||
| I | 800 | 2 | 2 | x | 1 | 5 |
| II | 900 | 1 | 2 | 0.5 | 0.5 | tm |
| III | 900 | 2 | 4 | y | y | tn |
(2)下列能判断在800℃实验条件下CO(g)与H2O(g)反应一定达到平衡状态的是D.
A.容器内压强不再变化 B.$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$=2
C.混合气体密度不变 D.υ正(CO)=υ逆(CO2)
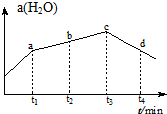
(3)实验Ⅲ中:y=1.
(4)若实验Ⅲ的容器改为在绝热的密闭容器中进行,实验测得H2O(g)的转化率a(H2O)随时间变化的示意图,如图所示,b点:υ正>υ逆(填“<”.“=”或“>”).
| A. | 温度升高,Na2CO3溶液pH减小 | |
| B. | 氢氧化钠溶液久置于空气中,溶液pH变大 | |
| C. | 新制氯水经光照一段时间后,溶液pH减小 | |
| D. | 温度升高,纯水pH增大 |


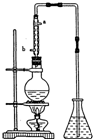 市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{{H}^{+}}{→}$ n(C2H4O)
市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{{H}^{+}}{→}$ n(C2H4O)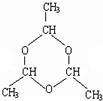 .
.