题目内容
(本题共10分)
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2=6SO2+Fe3O4,氧化产物为 ,若有3mol FeS2参加反应,转移 mol电子。
(2)与明矾相似,硫酸铁也可用作净水剂,其原理为 (用离子方程表示)。
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为 。
(4)在热的稀硫酸溶液中溶解一定量的FeSO4后,再加入足量的KNO3溶液,可使其中的Fe2+全部转化成Fe3+,并有气体逸出,请写出相应的离子方程式: 。
(5)铁红是一种红色颜料,其成分是Fe2O3将一定量的铁红溶于160mL 5mol?L-1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为 。
(1)SO2和Fe3O4 32 (2)Fe3++3H2O Fe(OH)3+3H+ (3)2Fe3++2I-=2Fe2++I2
Fe(OH)3+3H+ (3)2Fe3++2I-=2Fe2++I2
(4)3Fe2++NO3—+4H+ =3Fe3+ +NO↑+ 2H2O (5) 11.2g
【解析】
试题分析:(1)3FeS2+8O2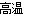 6SO2+Fe3O4中,Fe、S元素的化合价升高,O元素的化合价降低,SO2和Fe3O4为氧化产物。3molFeS2参加反应,由O元素的化合价变化可知,转移的电子为8mol×2×(2-0)=32mol;
6SO2+Fe3O4中,Fe、S元素的化合价升高,O元素的化合价降低,SO2和Fe3O4为氧化产物。3molFeS2参加反应,由O元素的化合价变化可知,转移的电子为8mol×2×(2-0)=32mol;
(2)硫酸铁溶于水Fe3+水解生成氢氧化铁胶体,胶体具有吸附性而净水,方程式为Fe3++3H2O Fe(OH)3+3H+;
Fe(OH)3+3H+;
(3)铁离子具有氧化性,能把碘离子氧化为单质碘,方程式为2Fe3++2I-=2Fe2++I2;
(4)在酸性条件下硝酸根具有氧化性,能把亚铁离子氧化为铁离子,而自身被还原为NO,反应的方程式为3Fe2++NO3—+4H+ =3Fe3+ +NO↑+ 2H2O;
(5)氢气的物质的量为2.24L÷22.4L/mol=0.1mol
Fe~~~~2HCl~~~H2
0.1mol 0.2mol 0.1mol
根据氯原子守恒,所以氯化铁的物质的量为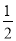 ×(0.16L×5mol/L-0.2mol)=0.2mol
×(0.16L×5mol/L-0.2mol)=0.2mol
Fe~~~2FeCl3
0.1mol 0.2mol
所以参加反应的铁粉的质量为(0.1mol+0.1mol)×56g/mol=11.2g
考点:考查铁的化合物参与反应的有关判断与计算

 灵星计算小达人系列答案
灵星计算小达人系列答案

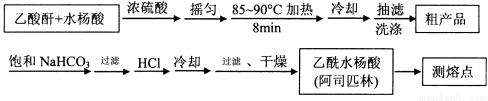
 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)  与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下: