题目内容
 Fe、Cu、Al是常见的金属元素,按要求回答下列问题:
Fe、Cu、Al是常见的金属元素,按要求回答下列问题:(1)向氯化铜溶液中加入一定量的铁粉和铝粉混合物,充分反应后,下列情况可能出现的是
a.溶液中有Cu2+、Fe2+、Al3+,不溶物为Cu
b.溶液中有Fe2+、Al3+,不溶物为Cu、Fe
c.溶液中有Fe3+、Al3+,不溶物为Cu
d.溶液中有Fe2+,不溶物为Cu、Al
(2)将一定质量的铁、铝、铜合金,加入1L 一定物质的量浓度的硝酸中,完全溶解,测得溶液中(忽略溶液体积的变化) c(H+)=0.5mol/L,c(Cu2+)=0.3mol/L,c(Al3+)=0.2mol/L,c(NO3-)=2mol/L,则混合物中铁的质量为
(3)在硫酸铜溶液中加入碘化钾溶液,有白色沉淀生成,溶液的颜色则由蓝色变为深黄色,经分析证明白色沉淀是碘化亚铜,该反应的离子方程式为
(4)Li-Al/FeS是一种可充电电池,电池中用含Li+导电固体作为电解质,在工作过程中Li+的物质的量保持不变,其正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe,则电池的负极反应式为
考点:铁的化学性质,化学电源新型电池,电解原理,铝的化学性质,铜金属及其重要化合物的主要性质
专题:电化学专题,几种重要的金属及其化合物
分析:(1)根据金属反应的先后顺序以及足量和不足两种情况进行分析,在金属活动性顺序中,铝和铁都能把位于其后的金属从其盐溶液中置换出来,但铝的活泼性强于铁,铝先与盐溶液反应,然后铁与与盐溶液反应;
(3)根据溶液中含有硝酸,所以铁以Fe3+的形式存在,然后再根据电荷守恒求出Fe3+的浓度以及其物质的量,最后根据质量守恒求出铁的物质的量和质量;
(3)根据题意生成物为碘化亚铜,单质碘,然后根据质量守恒配平;
(4)Li和Al都属于金属,合金中Li较Al活泼,根据正极反应式知,原电池的电极材料Li-Al/FeS,判断出负极材料为Li,失去电子,化合价升高;又知该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe,所以电池反应为:2Li+FeS=Li2S+Fe,充电时为电解池原理,阳极发生氧化反应,失去电子,化合价升高;
根据阴阳极上析出的物质判断要使电解后溶液恢复到电解前的状态需加入的物质;先根据电极方程式计算出电极上转移的电子数,而各个电极上转移的电子数是相等的最终求出b极上生成物质的质量.
(3)根据溶液中含有硝酸,所以铁以Fe3+的形式存在,然后再根据电荷守恒求出Fe3+的浓度以及其物质的量,最后根据质量守恒求出铁的物质的量和质量;
(3)根据题意生成物为碘化亚铜,单质碘,然后根据质量守恒配平;
(4)Li和Al都属于金属,合金中Li较Al活泼,根据正极反应式知,原电池的电极材料Li-Al/FeS,判断出负极材料为Li,失去电子,化合价升高;又知该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe,所以电池反应为:2Li+FeS=Li2S+Fe,充电时为电解池原理,阳极发生氧化反应,失去电子,化合价升高;
根据阴阳极上析出的物质判断要使电解后溶液恢复到电解前的状态需加入的物质;先根据电极方程式计算出电极上转移的电子数,而各个电极上转移的电子数是相等的最终求出b极上生成物质的质量.
解答:
(1)铝和铁都能把位于其后的金属从其盐溶液中置换出来,但铝的活泼性强于铁,铝先与盐溶液反应,
a.铝粉、铁粉都全部与溶液反应,且溶液过量,溶液中有Cu2+、Fe2+、Al3+,不溶物为Cu,故a正确;
b.铝粉部分与溶液反应、铁粉与溶液未反应,溶液中有Fe2+、Al3+,不溶物为Cu、Fe,故b正确;
c.铝粉氯化铜溶液反应生成氯化亚铁和铜,不可能生成Fe3+,故c错误;
d.铝先与氯化铜溶液反应,然后铁与氯化铜溶液反应,只要铝剩余,铁与氯化铜溶液就不反应,溶液中就不可能含有Fe2+,故d错误;
故选:ab;
(2)溶液中含有硝酸,所以铁以Fe3+的形式存在,溶液中的电荷守恒:c(H+)×1+c(Cu2+)×2+c(Al3+)×3+c(Fe3+)×3=c(NO3-)×1,即 0.5mol/L+0.3mol/L×2+0.2mol/L×3+c(Fe2+)×3=2mol/L,解得:c(Fe3+)=0.1mol/L,Fe3+的其物质的量为0.1mol/L×1L=0.1mol,铁的物质的量也为0.1mol,质量为0.1mol×56g/mol=5.6克,故答案为:5.6克;
(3)在硫酸铜溶液中加入碘化钾溶液,有白色沉淀碘化亚铜生成,同时生成了碘单质,即:2Cu2++4I-═2CuI↓+I2,故答案为:2Cu2++4I-=2CuI↓+I2
(4)Li和Al都属于金属,合金中Li较Al活泼,根据正极反应式知,原电池的电极材料Li-Al/FeS,判断出负极材料为Li,发生反应为:2Li-2e-=2Li+;又知该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe,所以电池反应为:2Li+FeS=Li2S+Fe,充电时为电解池原理,Fe发生氧化反应,失去电子,化合价升高;故答案为:2Li-2e-=2Li+;Fe;
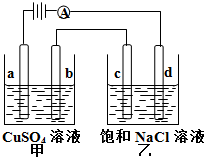
阴极上有铜生成,阳极上有氧气生成,所以要使电解后溶液恢复到电解前的状态需加入的物质是氧化铜;碳酸铜和硫酸反应生成硫酸铜和二氧化碳,所以也可加人碳酸铜;
当乙中溶液的pH是13时(此时乙溶液体积为500mL)时,根据电极反应2H20+2e-═H2↑+2OH-,OH-的物质的量为:0.1mol/l×0.5L=0.05mol,转移0.05mol电子,甲中在b极上发生反应:
Cu2++2e-═Cu,生成Cu的物质的质量为0.025mol,其质量为:0.025mol×64g/mol=1.6克,故答案为:CuO或CuCO3,1.6克.
a.铝粉、铁粉都全部与溶液反应,且溶液过量,溶液中有Cu2+、Fe2+、Al3+,不溶物为Cu,故a正确;
b.铝粉部分与溶液反应、铁粉与溶液未反应,溶液中有Fe2+、Al3+,不溶物为Cu、Fe,故b正确;
c.铝粉氯化铜溶液反应生成氯化亚铁和铜,不可能生成Fe3+,故c错误;
d.铝先与氯化铜溶液反应,然后铁与氯化铜溶液反应,只要铝剩余,铁与氯化铜溶液就不反应,溶液中就不可能含有Fe2+,故d错误;
故选:ab;
(2)溶液中含有硝酸,所以铁以Fe3+的形式存在,溶液中的电荷守恒:c(H+)×1+c(Cu2+)×2+c(Al3+)×3+c(Fe3+)×3=c(NO3-)×1,即 0.5mol/L+0.3mol/L×2+0.2mol/L×3+c(Fe2+)×3=2mol/L,解得:c(Fe3+)=0.1mol/L,Fe3+的其物质的量为0.1mol/L×1L=0.1mol,铁的物质的量也为0.1mol,质量为0.1mol×56g/mol=5.6克,故答案为:5.6克;
(3)在硫酸铜溶液中加入碘化钾溶液,有白色沉淀碘化亚铜生成,同时生成了碘单质,即:2Cu2++4I-═2CuI↓+I2,故答案为:2Cu2++4I-=2CuI↓+I2
(4)Li和Al都属于金属,合金中Li较Al活泼,根据正极反应式知,原电池的电极材料Li-Al/FeS,判断出负极材料为Li,发生反应为:2Li-2e-=2Li+;又知该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe,所以电池反应为:2Li+FeS=Li2S+Fe,充电时为电解池原理,Fe发生氧化反应,失去电子,化合价升高;故答案为:2Li-2e-=2Li+;Fe;
阴极上有铜生成,阳极上有氧气生成,所以要使电解后溶液恢复到电解前的状态需加入的物质是氧化铜;碳酸铜和硫酸反应生成硫酸铜和二氧化碳,所以也可加人碳酸铜;
当乙中溶液的pH是13时(此时乙溶液体积为500mL)时,根据电极反应2H20+2e-═H2↑+2OH-,OH-的物质的量为:0.1mol/l×0.5L=0.05mol,转移0.05mol电子,甲中在b极上发生反应:
Cu2++2e-═Cu,生成Cu的物质的质量为0.025mol,其质量为:0.025mol×64g/mol=1.6克,故答案为:CuO或CuCO3,1.6克.
点评:本题是一道综合题,考查的知识点较多,难度中等以上,要求学生熟记教材知识,学以致用.

练习册系列答案
相关题目
在水溶液中能大量共存的离子组是( )
A、Fe3+、Na+、SO
| ||
B、H+、Fe2+、CI-、NO
| ||
C、Ag+、Na+、CO
| ||
D、AI3+、K+、CI-、AIO
|
NA代表阿伏加德罗常数,下列叙述错误的是( )
| A、标准状况下,22.4LO2和N2的混合气体中分子总数为NA |
| B、常温常压下,1molI2固体中,含有I原子数为2NA |
| C、Na2O2与H2O反应生成16gO2时,转移电子数为NA |
| D、标准状况下,分子数均为NA的H2和H2O,它们所占的体积相同 |
下列离子方程式与所述事实相符且正确的是( )
| A、向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO4-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4 |
| B、在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3═FeO42-+3Cl-+H2O+H+ |
| C、向NaAlO2溶液中通入过量CO2制Al(OH)3:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO |
| D、Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++HCO3++OH-═CaCO3↓+H2O |
能正确表示下列各组溶液混合后,所得液体恰好呈中性的离子方程式是( )
| A、Ba(OH)2和NaHSO4:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| B、Ba(OH)2和NaHSO4:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| C、Ba(OH)2和KAl(SO4)2:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2- |
| D、Ba(OH)2和KAl(SO4)2:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ |