题目内容
在室温下,下列五种溶液:
①0.1mol/L NH4Cl
②0.1mol/L CH3COONH4
③0.1mol/L NH4HSO4
④0.1mol/L NH3?H2O和0.1mol/L NH4Cl混合液 ⑤0.1mol/L NH3?H2O
请根据要求填写下列空白:
(1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是 .(用离子方程式表示)
(2)比较溶液②、③中c(NH4+)的大小关系是② ③(填“>”、“<”或“=”).
(3)在溶液④中, 离子的浓度为0.1mol/L;NH3?H2O和 (填化学式)的物质的量浓度之和为0.2mol/L.
(4)室温下,测得溶液②的pH=7,则说明CH3COO-的水解程度 (填“>”、“<”或“=”)NH4+的水解程度,CH3COO-与NH4+浓度的大小关系是:c(CH3COO-) c(NH4+)(填“>”、“<”或“=”).
①0.1mol/L NH4Cl
②0.1mol/L CH3COONH4
③0.1mol/L NH4HSO4
④0.1mol/L NH3?H2O和0.1mol/L NH4Cl混合液 ⑤0.1mol/L NH3?H2O
请根据要求填写下列空白:
(1)溶液①呈
(2)比较溶液②、③中c(NH4+)的大小关系是②
(3)在溶液④中,
(4)室温下,测得溶液②的pH=7,则说明CH3COO-的水解程度
考点:弱电解质在水溶液中的电离平衡,离子浓度大小的比较
专题:电离平衡与溶液的pH专题
分析:(1)NH4Cl为强酸弱碱盐,水解呈酸性;
(2)CH3COONH4中铵根离子和醋酸根离子发生相互促进的水解;NH4HSO4中电离的氢离子抑制铵根离子水解;
(3)氯离子不水解;根据溶液中的物料守恒分析;
(4)0.1mol/L CH3COONH4的pH=7,显中性则CH3COO-的水解程度与NH4+的水解程度相同,根据电荷守恒分析.
(2)CH3COONH4中铵根离子和醋酸根离子发生相互促进的水解;NH4HSO4中电离的氢离子抑制铵根离子水解;
(3)氯离子不水解;根据溶液中的物料守恒分析;
(4)0.1mol/L CH3COONH4的pH=7,显中性则CH3COO-的水解程度与NH4+的水解程度相同,根据电荷守恒分析.
解答:
解:(1)氯化铵为强酸弱碱盐,铵根离子水解的离子方程式为NH4++H2O?H++NH3?H2O,故答案为:NH4++H2O?H++NH3?H2O;
(2)CH3COONH4中铵根离子和醋酸根离子发生相互促进的水解,水解程度较大;NH4HSO4中电离的氢离子抑制铵根离子水解,铵根离子水解程度较小,水解程度越大,则离子浓度越小,所以CH3COONH4中铵根离子浓度小于NH4HSO4中铵根离子浓度,故答案为:<;
(3)氯离子在溶液中不水解,则其浓度不变,所以Cl-的浓度为0.1mol/L;0.1mol/L NH3?H2O和0.1mol/L NH4Cl混合液中,存在物料守恒,则NH3?H2O和 NH4+的物质的量浓度之和为0.2mol/L;
故答案为:Cl-;NH4+;
(4)0.1mol/L CH3COONH4的pH=7,显中性则CH3COO-的水解程度与NH4+的水解程度相同;CH3COONH4溶液中存在电荷守恒:c(CH3COO-)+c(OH-)=c(NH4+)+c(H+),已知显中性,则c(OH-)=c(H+),所以c(CH3COO-)=c(NH4+),故答案为:=;=.
(2)CH3COONH4中铵根离子和醋酸根离子发生相互促进的水解,水解程度较大;NH4HSO4中电离的氢离子抑制铵根离子水解,铵根离子水解程度较小,水解程度越大,则离子浓度越小,所以CH3COONH4中铵根离子浓度小于NH4HSO4中铵根离子浓度,故答案为:<;
(3)氯离子在溶液中不水解,则其浓度不变,所以Cl-的浓度为0.1mol/L;0.1mol/L NH3?H2O和0.1mol/L NH4Cl混合液中,存在物料守恒,则NH3?H2O和 NH4+的物质的量浓度之和为0.2mol/L;
故答案为:Cl-;NH4+;
(4)0.1mol/L CH3COONH4的pH=7,显中性则CH3COO-的水解程度与NH4+的水解程度相同;CH3COONH4溶液中存在电荷守恒:c(CH3COO-)+c(OH-)=c(NH4+)+c(H+),已知显中性,则c(OH-)=c(H+),所以c(CH3COO-)=c(NH4+),故答案为:=;=.
点评:本题考查了盐的水解、溶液中电荷守恒和物料守恒的应用,题目难度中等,注意把握溶液中电荷守恒和物料守恒的应用方法.

练习册系列答案
相关题目
常温下,下列各组离子可能大量共存的是( )
| A、能使甲基橙显黄色的溶液:Cl-、CO32-、K+、AlO2- |
| B、含CO32-的溶液:Ca2+、Na+、Cl-、NO3- |
| C、加入Al能放出H2的溶液中:Cl-、SO42-、NH4+、NO3-、Mg2+ |
| D、在由水电离出的c(OH-)=10-13mol?L-1的溶液中:[Ag(NH3)2]+、Na+、Fe2+、AlO2-、I- |
去甲肾上腺素可以调控动物机体的植物性神经功能,其结构简式如图所示.下列说法正确的是( )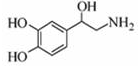

| A、每个去甲肾上腺素分子中含有3个酚羟基 |
| B、1mol去甲肾上腺素最多能与2molBr2 |
| C、甲肾上腺素分子不能与饱和的碳酸氢钠溶液发生反应 |
| D、去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应 |
下列关于蛋白质的说法不正确的是( )
| A、重金属盐能使蛋白质变性,所以误食重金属盐时,可以喝牛奶解毒 |
| B、阿胶的主要成分是蛋白质,蚕丝的主要成份是纤维素 |
| C、蛋白质溶液中加入饱和硫酸铵溶液,蛋白质析出,再加水,重新溶解 |
| D、浓硝酸溅到皮肤上,会使皮肤呈现黄色 |
把200mL NH4HCO3和Na2CO3的混合溶液分成两等份,取一份加入含amol NaOH的溶液恰好反应完全;取另一份加入含bmol HCl的盐酸恰好反应完全.该混合溶液中c(Na+)为( )
| A、(l0b-5a))mol/L | ||||
| B、(2b-a)mol/L | ||||
C、(
| ||||
D、(5b-
|

