题目内容
14.根据下列事实得出的结论正确的是( )| A. | 试样$→_{水浴加热}^{银氨溶液}$产生银镜结论:该试样是醛类 | |
| B. | 某卤代烃试样$→_{加热}^{氢氧化钠溶液}$$\stackrel{滴入硝酸银溶液}{→}$最终的沉淀不是白色.结论:该卤代烃中不含氯原子 | |
| C. | 某溶液$\stackrel{打开瓶盖}{→}$冒着白雾$\stackrel{用蘸有浓氨水玻璃棒}{→}$产生大量白烟,结论:此溶液为浓盐酸 | |
| D. | 无色溶液$\stackrel{焰色反应}{→}$呈黄色:结论:此溶液一定含有钠元素 |
分析 A.有银镜生成,有机物中一定含-CHO;
B.检验氯离子应在酸性条件下;
C.产生白烟可能生成硝酸铵;
D.钠的焰色反应为黄色.
解答 解:A.有银镜生成,有机物中一定含-CHO,则该有机物可能为醛、葡萄糖、甲酸或甲酸某酯等,故A错误;
B.检验氯离子应在酸性条件下,应加入稀硝酸,故B错误;
C.产生白烟可能生成硝酸铵或氯化铵,则挥发性酸可能为硝酸和盐酸,则此溶液可能为浓盐酸,故C错误;
D.钠的焰色反应为黄色,则无色试液焰色反应呈黄色,结论:试液中一定含有钠元素,故D正确.
故选D.
点评 本题考查化学实验方案的评价,涉及物质的检验等知识,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同以及实验的严密性和可行性的评价,难度中等.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
9.下列描述不正确的是( )
| A. | 氯气具有漂白性和氧化性 | B. | 氨水中含有六种微粒 | ||
| C. | 氯水中含有七种微粒 | D. | 一氧化氮具有还原性 |
10.下列反应不属于可逆反应的是( )
| A. | CO2+H2O→H2CO3 | B. | H2+I2→HI | C. | NH3+HCl→NH4Cl | D. | SO2+O2→SO3 |
2.下列叙述正确的是( )
| A. | 某溶液的pH<7,说明该溶液一定呈酸性 | |
| B. | 常温时pH=3的盐酸溶液与pH=5盐酸溶液等体积混合后溶液的pH=4 | |
| C. | 0.2 mol•L-1的盐酸,与等体积水混合后pH=1 | |
| D. | 常温时pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7 |
9.下列判断正确的是( )
| A. | 同体积、同浓度的NaF和NaCl溶液中,所有离子总数,N(NaCl)>N(NaF);同体积同浓度的Na2CO3和Na2SO4溶液中,所有离子总数,N(Na2CO3)>N(Na2SO4) | |||||||||||
| B. | 以下是某温度下高氯酸、硫酸、硝酸和盐酸在冰醋酸中的电离常数,则在冰醋酸中硫酸的电离方程式可表示为H2SO4?2H++SO42-
| |||||||||||
| C. | 已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中,[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-)] | |||||||||||
| D. | 平衡体系CaCO3(s)?CaO(s)+CO2中仅含有碳酸钙、氧化钙及二氧化碳气体.某时刻,保持温度不变,将容器体积缩小为原来的一半并保持不变,则二氧化碳浓度增大 |
6.在汽车尾气处理装置中加入某种催化剂,发生如下反应:4CO+2NO2═4CO2+N2.下列对该反应的说法中错误的是( )
| A. | 该反应中氧化剂是CO、还原剂是NO2 | |
| B. | 该反应是氧化还原反应 | |
| C. | 该反应生成28 g N2时,转移8 mol e- | |
| D. | 该反应能减少汽车尾气对环境的污染 |
3.轨道表示式是表示原子核外电子运动状态的一种化学用语,下列有关原子的最外层的轨道表示式正确的是( )
| A. | 铍原子 | B. | 碳原子 | ||
| C. | 氯原子 | D. | 铝原子 |
 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
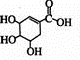 +Br2→
+Br2→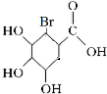 .
.