题目内容
下列事实,不能用勒沙特列原理解释的是( )
| A、溴水中有下列平衡Br2+H2O?HBr+HBrO 当加入AgNO3溶液后,溶液颜色变浅 |
| B、合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施 |
| C、反应CO+NO2?CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动 |
| D、对2HI(g)?H2(g)+I2(g),平衡体系增大压强可使颜色变深 |
考点:化学平衡移动原理
专题:
分析:勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应且存在平衡过程,否则勒夏特列原理不适用.
解答:
解:A.加入AgNO3溶液,与HBr反应,平衡正向移动,能用勒沙特列原理解释,故A不选;
B、合成氨的正反应是放热反应,降低温度平衡向逆反应方向移动,为提高NH3的产率,理论上应采取低温度的措施,所以能用勒夏特列原理解释,故B不选;
C、该反应是放热反应,升高温度,平衡向逆反应方向移动,能用勒夏特列原理解释,故B不选;
D、该反应反应前后气体体积不变,所以压强不影响化学平衡的移动,增大平衡体系的压强气体的体积减小,碘的浓度增大,颜色变深,所以不能用勒夏特列原理解释,故D正确;
故选D.
B、合成氨的正反应是放热反应,降低温度平衡向逆反应方向移动,为提高NH3的产率,理论上应采取低温度的措施,所以能用勒夏特列原理解释,故B不选;
C、该反应是放热反应,升高温度,平衡向逆反应方向移动,能用勒夏特列原理解释,故B不选;
D、该反应反应前后气体体积不变,所以压强不影响化学平衡的移动,增大平衡体系的压强气体的体积减小,碘的浓度增大,颜色变深,所以不能用勒夏特列原理解释,故D正确;
故选D.
点评:本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆反应.

练习册系列答案
相关题目
某有机物是药物生产的中间体,其结构如图.下列有关叙述不正确的是( )
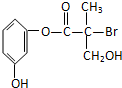

| A、该有机物与浓溴水可发生取代反应,1 mol该有机物可消耗3 mol溴 |
| B、该有机物与浓硫酸混合共热可发生消去反应 |
| C、1 mol该有机物与足量NaOH溶液反应最多消耗4 mol NaOH |
| D、1 mol该有机物催化加氢最多消耗3 mol氢气 |
下列叙述正确的是( )
| A、晶体中只要有阳离子就一定有阴离子 |
| B、金刚石和冰在熔化时克服的作用力相同 |
| C、HCl晶体由H+和Cl-构成 |
| D、原子晶体里,所有原子都以共价键相互结合 |
下列物质的性质、用途正确的是( )
| A、浓硫酸、浓硝酸都具有强氧化性,不能盛放在金属容器中 |
| B、明矾和漂白粉常用于自来水的净化,两者的作用原理完全相同 |
| C、Na2SiO3是制备硅胶和木材防火剂的原料 |
| D、合金的硬度比纯金属大,熔点也比纯金属高 |
下列说法不正确的是( )
| A、《京都议定书》针对六种温室气体进行削减,包括二氧化碳(CO2)、甲烷(CH4)、氧化亚氮(N2O)、氢氟碳化物(HFCs)、全氟碳化物(PFCs)及六氟化硫(SF6).科学研究发现,同条件下等体积的甲烷产生的温室效应远远强于二氧化碳的.那么等质量的二氧化碳产生温室效应比甲烷的强 |
| B、合成高学科王效、稳定、廉价的太阳能光电转化材料,是开发利用太阳能的关键 |
| C、稀土元素都是长周期元素,稀土资源是国家战略性资源 |
| D、环境问题的最终解决要依靠科技进步,通常利用沉淀反应除去污水中的重金属离子 |
固体氧化物燃料电池(SOFC)以固体氧化物作为电解质.其工作原理如图所示:下列关于固体燃料电池的有关说法正确的是( )
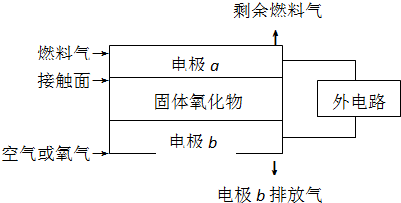

| A、电极b为电池负极,电极反应式为2O2+4e-=4O2- |
| B、固体氧化物的作用是让电子在电池内通过 |
| C、若H2作为燃料气,则接触面上发生的反应为H2+2OH--4e-=2H++H2O |
| D、若C2H4作为燃料气,则接触面上发生的反应为C2H4+6O2--12e-=2CO2+2H2O |
下列化学用语表示正确的是( )
| A、Na+的电子排布式:1s22s22p63s1 |
| B、Fe的简化电子排布式:[Ar]4s2 |
| C、Cr的外围电子排布式:3d54s1 |
D、N的最外层电子排布图: |
等物质的量的CH4和NH3相比较,下列结论错误的是?( )
| A、它们的分子个数比为1:1 |
| B、它们的原子个数比为5:4 |
| C、它们的电子个数比为1:1 |
| D、它们的体积比为1:1 |
下列各组离子能在酸性的无色溶液中大量共存的是( )
| A、Na+、NH4+、Cl-、CO32- |
| B、Fe3+、Mg2+、SO42-、NO3- |
| C、Ba2+、Ca2+、Br-、SO42- |
| D、Zn2+、Ca2+、NO3-、Cl- |