题目内容
【题目】Ⅰ.(1)在一定条件下,CH4可与NOx反应除去NOx,已知下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1
②N2(g)+2O2(g)![]() 2NO2(g) △H=+67.0kJ·mol-1
2NO2(g) △H=+67.0kJ·mol-1
③H2O(g)=H2O(l) △H=-41.0kJ·mol-1
则CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2(g) △H=_________kJ·mol-1;
CO2(g)+2H2O(g)+N2(g) △H=_________kJ·mol-1;
(2)哈伯因证实N2、H2在固体催化剂(Fe)表面吸附和解吸以合成氨的过程而获诺贝尔奖。若用![]() 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:

①吸附后,能量状态最低的是 (填字母序号)。
②由上述原理,在铁表面进行NH3的分解实验,发现分解速率与浓度关系如图。
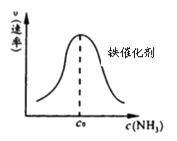
从吸附和解吸过程分析,c0前速率增加的原因可能是 ;c0后速率降低的原因可能是 。
Ⅱ.用石墨作电极电解下列溶液:
①稀H2SO4②K2SO4溶液 ③NaCl溶液 ④CuSO4溶液 ⑤KOH溶液
(1)阴极、阳极都有气体产生,其中溶液pH变大的是______________。(填序号)
(2)已知400mL 0.5 mol·L-1 CuSO4溶液,电解一段时间后,两极产生的气体体积相同,其阳极的电极反应式是_________________,两极共产生气体______________ mol,如要将溶液恢复原浓度,需要加入的物质为______________。
【答案】Ⅰ.(1)—875.3(2)①C;(1分)②氨的浓度增加,催化剂表面吸附的氨分子增多,速率增大,达到一定浓度后,氨分子浓度太大阻碍N2和H2的解吸。
Ⅱ.(1)③⑤(2)4OH--4e-=2H2O+O2↑;0.4;CuO和水(其他答案合理给分)
【解析】
试题分析:Ⅰ.(1)①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ·mol-1
②N2(g)+2O2(g)![]() 2NO2(g)△H=+67.0kJ·mol-1
2NO2(g)△H=+67.0kJ·mol-1
③H2O(g)=H2O(l)△H=-41.0kJ·mol-1
根据盖斯定律可知①-②-③×2可得:CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2(g)
CO2(g)+2H2O(g)+N2(g)
△H=(-890.3-67.0+41.0×2)kJ·mol-1=—875.3kJ·mol-1;
(2)①由于化学键的断裂要吸收能量,故活化状态B的能量高于初始状态A的能量,而此反应为放热反应,故初始状态A的能量高于末态C的能量,故C的能量最低;②c0前氨的浓度增加,导致反应速率加快;c0后由于氨分子浓度太大阻碍N2和H2的解吸,故反应速率减慢;
Ⅱ.(1)由给出电解质溶液可知,阴阳极都有气体产生,实质是(ⅰ)电解的水生成氧气与氢气,电解质溶液应为:①稀H2SO4、②K2SO4溶液、⑤KOH溶液.电解后溶液的浓度增大,①稀H2SO4电解后溶液的酸性增强,溶液PH值不变,②K2SO4溶液是中性溶液,电解后溶液PH值不变,⑤KOH溶液电解后溶液的碱性增强,溶液PH值增大;(ⅱ)电解③NaCl溶液,生成氢气和氯气,同时生成NaOH溶液,溶液的pH增大,故答案为③⑤;
(2)400mL 0.5 mol·L-1 CuSO4溶液中CuSO4的物质的量为0.2mol,最初电解时生成铜和氧气,电极反应式为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,完全电解生成的O2为0.1mol,继续电解时生成氢气和氧气,根据电子守恒规律,两极产生的气体体积相同时,H2和氧气的物质的量均为0.2mol,共产生气体的物质的量为0.4mol;根据电解什么,补什么的原则,可以添加0.2molCuO和0.2molH2O即可恢复原浓度,也可以添加0.2molCu(OH)2达到相同效果。
2Cu+O2↑+2H2SO4,完全电解生成的O2为0.1mol,继续电解时生成氢气和氧气,根据电子守恒规律,两极产生的气体体积相同时,H2和氧气的物质的量均为0.2mol,共产生气体的物质的量为0.4mol;根据电解什么,补什么的原则,可以添加0.2molCuO和0.2molH2O即可恢复原浓度,也可以添加0.2molCu(OH)2达到相同效果。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案