题目内容
8.10.6g Na2CO3中有0.2mol钠原子,有0.1NA个碳原子,有0.3NA个氧原子,有5.2mol电子,有5.2NA个质子.分析 根据n=$\frac{m}{M}$计算出10.6g Na2CO3的物质的量,然后可得出含有钠原子、碳原子、氧原子的物质的量;碳酸钠含有的电子数=质子数=52,根据N=nNA计算出含有的碳原子、氧原子、电子和质子数.
解答 解:10.6g Na2CO3的物质的量为:n(Na2CO3)=$\frac{10.6g}{106g/mol}$=0.1mol,0.1mol Na2CO3中含有钠原子的物质的量为:n(Na)=0.1mol×2=0.2mol;含有碳原子的物质的量为:n(C)=n(Na2CO3)=0.1mol,数目为0.1NA;含有O原子的物质的量为:n(O)=0.1mol×3=0.3mol,数目为0.3NA;含有的电子、质子的物质的量相等,都为0.1mol×52=5.2mol,数目为5.2NA,
故答案为:0.2;0.1NA;0.3NA;5.2;5.2NA.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与阿伏伽德罗常数、摩尔质量之间的关系即可解答,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
16.下列关于H2S分子的化学用语正确的是( )
| A. |  | B. |  | C. |  | D. | 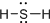 |
3.下列说法错误的是( )
| A. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| B. | 放热反应和吸热反应决定于反应物的总能量与生成物的总能量的相对大小 | |
| C. | 已知:S(s)+O2(g)=SO2(g)△H1;S(g)+O2(g)=SO2(g)△H2;则△H1>△H2 | |
| D. | 凡经加热而发生的化学反应都是吸热反应 |
13.下列离子方程式正确的是( )
| A. | 硫酸溶液与氢氧化钡溶液混合:Ba2++SO42-=BaSO⒋↓ | |
| B. | 稀硫酸中加入铜片:Cu+2H+=Cu2++H2↑ | |
| C. | 氧化铜溶于盐酸:O2-+2H+=H2O | |
| D. | 二氧化碳通入足量澄清石灰水:Ca2++2OHˉ+CO2=CaCO3↓+H2O |
20.下列反应中,属于吸热反应的是( )
| A. | 氢氧化钠溶液与稀盐酸混合 | B. | 消石灰与氯化铵固体混合 | ||
| C. | 镁条与稀盐酸反应 | D. | 铝粉与氧化铁粉末共热 |
17.用NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 0.1 mol/L稀硫酸中含有硫酸根数目为0.1NA | |
| B. | 9g H2O中含有H数目为1mol | |
| C. | 2.4g金属镁与足量的盐酸反应,生成氢分子数目为2NA | |
| D. | 1mol NH4+中含有电子数为10NA |
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: