题目内容
13.下列有关的离子方程式书写正确的是( )| A. | 氢氧化钡溶液和稀硫酸反应:Ba2++SO42-=BaSO4↓ | |
| B. | 浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 氯气通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 钠放于水中:2Na+2H2O=2Na++2OH-+H2↑ |
分析 A.漏写生成水的离子反应;
B.反应生成氯化亚铁和氢气;
C.反应生成的HClO在离子反应中保留化学式;
D.反应生成NaOH和氢气,遵循电子、电荷守恒.
解答 解:A.氢氧化钡溶液和稀硫酸反应的离子反应为2H++2OH-+Ba2++SO42-=BaSO4↓+2H2O,故A错误;
B.浓盐酸与铁屑反应的离子反应为Fe+2H+=Fe2++H2↑,故B错误;
C.氯气通入水中的离子反应为Cl2+H2O=H++Cl-+HClO,故C错误;
D.钠放于水中的离子反应为2Na+2H2O=2Na++2OH-+H2↑,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
4.下列说法正确的是( )
| A. | 生铁比纯铁更易锈蚀 | |
| B. | 构成原电池的正极和负极必须是两种不同的金属 | |
| C. | 纯银器在空气中表面渐渐变暗是因为发生了原电池反应 | |
| D. | 充电电池的充放电次数有限是由它的工作原理所决定的 |
1.下列说法正确的是( )
| A. | 燃料电池的电极包含活性物质,参与电极反应 | |
| B. | 氢氧燃料电池工作时发出蓝色火焰 | |
| C. | 铁在干燥的空气中不易生锈,在潮湿的空气中易生锈,主要是因发生电化腐蚀 | |
| D. | 温度一定时,催化剂不仅可以加快化学反应速率,而且可以改变反应物的转化率 |
5.16O和18O是氧元素的两种核素,NA 表示阿伏加德罗常数,下列说法正确的是( )
| A. | 16O2与18O2互为同分异构体 | |
| B. | 16O与18O核外电子排布方式不同 | |
| C. | 16O与18O的质量数相同 | |
| D. | 标准状况下,1.12 L 16O2和1.12 L 18O2均含0.1 NA 个氧原子 |
2.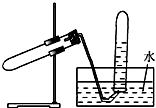 如图所示装置可用于( )
如图所示装置可用于( )
 如图所示装置可用于( )
如图所示装置可用于( )| A. | 加热NaHCO3制CO2 | B. | 用Cu和浓HNO3反应制NO2 | ||
| C. | 用Zn与稀硫酸反应制H2 | D. | 用NaCl与浓H2SO4加热制HCl |
3.在l℃时,10mL0.4mol•L-1H2O2溶液发生催化分解:2H2O2 $\frac{\underline{\;催化剂\;}}{\;}$ 2H2O+O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表:
下列叙述不正确的是(溶液体积变化忽略不计)( )
| t/min | 0 | 2 | 4 | 6 |
| V( 02 )/mL | 0.0 | 9.9 | 17.2 | 22.4 |
| A. | 0-2min的平均反应速率比4-6min快 | |
| B. | 0-6min 的平均反应速率v( H2O2)=3.3 x 10-2 moL-1•min-1 | |
| C. | 反应至 6min 时,c( H2O2)=0.3mol•L-1 | |
| D. | 反应至6min时,H2O2分解了 50% |
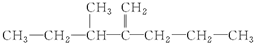 ,此烃名称为3-甲基-2-丙基-1-戊烯
,此烃名称为3-甲基-2-丙基-1-戊烯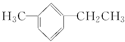 ,可命名为1-甲基-3-乙基苯(或3-甲基乙苯或间甲基乙苯);.
,可命名为1-甲基-3-乙基苯(或3-甲基乙苯或间甲基乙苯);.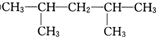
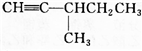 .
.