题目内容
13.氨在人类的生产和生活中有着广泛的应用.某化学兴趣小组利用图一装置探究氨气的有关性质.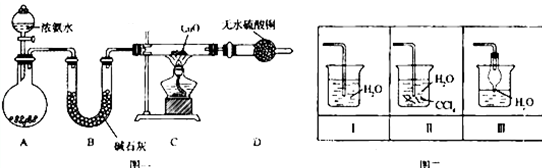
(1)装置A中烧瓶内试剂可选用碱石灰或生石灰(填序号).
(2)实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为3CuO+2NH3$\frac{\underline{\;加热\;}}{\;}$3Cu+N2+3H2O.该反应证明氨气具有还原性.
(3)该实验缺少尾气吸收装置,图二中能用来吸收尾气的装置是Ⅱ、Ⅲ(填装置序号).
(4)氨气极易溶于水,若标准状况下,将2.24L的氨气溶于水配成0.5L溶液,所得溶液的物质的量浓度为0.2mol/L.
分析 浓氨水在碱石灰或生石灰的作用下挥发生成氨气,在B中用碱石灰干燥,在C中加热体积与氧化铜发生氧化还原反应生成水、氮气和铜,D可用于检验是否生成水,最后氨气用水吸收,因氨气极易溶于水,注意防止倒吸,
(1)装置A是制备氨气的发生装置,浓氨水滴入固体碱石灰或氧化钙或固体氢氧化钠都可以生成氨气;
(2)依据反应现象可知,氧化铜氧化氨气为氮气,氧化铜被还原为铜;
(3)氨气极易溶于水尾气吸收需要防止倒吸;
(4)依据氨水溶液中溶质为氨气,结合物质的量浓度概念计算.
解答 解:浓氨水在碱石灰或生石灰的作用下挥发生成氨气,在B中用碱石灰干燥,在C中加热体积与氧化铜发生氧化还原反应生成水、氮气和铜,D可用于检验是否生成水,最后氨气用水吸收,因氨气极易溶于水,注意防止倒吸,
(1)装置A是制备氨气的发生装置,浓氨水滴入固体碱石灰或氧化钙或固体氢氧化钠都可以生成氨气,所以装置A中试剂为:碱石灰或生石灰;
故答案:碱石灰或生石灰;
(2)实验中观察到C中CuO粉末变红证明生成铜,D中无水硫酸铜变蓝生成水,并收集到一种单质气体,依据氧化还原反应分析,氧化铜氧化氨气为氮气,氧化铜被还原为铜,反应的化学方程式为:3CuO+2NH3$\frac{\underline{\;加热\;}}{\;}$3Cu+N2+3H2O;氮元素化合价升高为0价,做还原剂具有还原性,
故答案为:3CuO+2NH3 $\frac{\underline{\;加热\;}}{\;}$3Cu+N2+3H2O;还原;
(3)氨气极易溶于水尾气吸收需要防止倒吸,图二中能用来吸收尾气的装置是Ⅱ、Ⅲ,装置Ⅰ易发生倒吸,故答案为:Ⅱ、Ⅲ;
(4)氨气极易溶于水,若标准状况下,将2.24L的氨气溶于水配成0.5L溶液,溶质氨气物质的量为0.1mol,所得溶液的物质的量浓度=$\frac{0.1mol}{0.5L}$=0.2mol/L,
故答案为:0.2.
点评 本题考查氨气的制备以及氨气的性质探究,为高考常见题型和高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验的原理以及实验基本操作方法,难度中等.

 阅读快车系列答案
阅读快车系列答案 +H2O$→_{②H+}^{①OH-,△}$
+H2O$→_{②H+}^{①OH-,△}$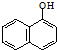 +CO2↑+CH3NH2,
+CO2↑+CH3NH2,则下列说法正确的是( )
| A. | 西维因是一种芳香烃 | |
| B. | 西维因苯环上一溴取代产物有4种情况 | |
| C. | 可用FeCl3溶液检验西维因是否发生水解 | |
| D. | 在Ni催化下1mol西维因最多能与6molH2加成 |
| A. | Na:O:H | B. | Na+[:O:H]- | C. | N::N | D. | H+[:Cl:]- |
 是某原子的结构示意图,下列关于该原子的描述正确的是( )
是某原子的结构示意图,下列关于该原子的描述正确的是( )| A. | 容易得到电子 | B. | 属于非金属原子 | ||
| C. | 核电荷数为11 | D. | 最外层电子数为11 |
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g),△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g),△H=-1160kJ•mol-1
下列说法正确的是( )
| A. | 由反应①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l),△H>-574 kJ•mol-1 | |
| B. | 反应①②转移的电子数不相同 | |
| C. | 若用标准状况下4.48L CH4 还原NO2至N2,放出的热量为173.4kJ | |
| D. | 若用标准状况下4.48L CH4 还原NO2至N2,整个过程中转移的电子总数为0.8mol |
| 元素代号 | 元素性质或原子结构 |
| T | 第二层上的电子数是第一层的3倍 |
| R | 与T 同一族 |
| L | L2+与T2-的核外电子数相等 |
| Z | 元素最高正价是+3价,与L同周期 |
| A. | 氢化物的稳定性为H2T<H2R | |
| B. | 单质与稀盐酸反应的速率为L<Z | |
| C. | Z与T形成的化合物具有两性 | |
| D. | L与R通过离子键形成的化合物阴阳离子的核外电子数相等 |
| A. | 标准状况下,1mol任何气体物质的体积都约为22.4L | |
| B. | 1mol气体的体积约为22.4L | |
| C. | 标准状况下,1molO2和N2混合气(任意比)的体积约为22.4L | |
| D. | 任何条件下,气体的摩尔体积都是22.4L |
| 化学键 | C-C | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 750 | 463 |