题目内容
(8分)工业生产硝酸铵的流程图如下:请回答下列问题:
(1)写出硝酸铵在工农业生产中的重要作用_____________________________(任写一条)。

(2)已知N2(g)+3H2(g) 2NH3(g),ΔH=-92.4 kJ·mol-1。
2NH3(g),ΔH=-92.4 kJ·mol-1。
在一定温度压强和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量___________(填“<” “>” “=”)92.4kJ,理由是 。
(3)写出氨催化氧化的化学方程式:___________________________________________________。
(8分)( 1)可做氮肥等;
(2)<, 在常温常压条件下,1mol氮气和3mol氢气完全反应生成2mol氨气,放出92.4kJ热量,该反应为可逆反应,不可能进行完全,所以放出的热量小于92.4kJ;
(3)4NH3+5O2 4NO+6H2O
4NO+6H2O
【解析】
试题分析:(1)硝酸铵中含有N元素,是农作物需要的元素,所以可作氮肥;
(2)可逆反应中,氮气与氢气不会完全转化,所以向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量小于92.4kJ;理由就是在常温常压条件下,1mol氮气和3mol氢气完全反应生成2mol氨气,放出92.4kJ热量,该反应为可逆反应,不可能进行完全,所以放出的热量小于92.4kJ;
(3)氨气与氧气在催化剂、加热的条件下反应生成NO和水,化学方程式为4NH3+5O2 4NO+6H2O。
4NO+6H2O。
考点:考查可逆反应的热效应的判断,化学方程式的书写

下述根据下列操作和现象,所得结论正确的是
实验操作及现象 | 实验结论 | |
A | 分别向2 mL 0.1 mol·L-1 CH3COOH溶液和2 mL 0.1 mol·L-1 H3BO3溶液中滴加等浓度的NaHCO3溶液,前者有气泡产生,后者无明显现象 | 酸性: CH3COOH > H2CO3> H3BO3 |
B | 向浓度均为0.1 mol·L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3溶液,产生黄色沉淀 | 溶度积: Ksp(AgCl)<Ksp(AgI) |
C | 向无水乙醇中加入浓H2SO4,加热,产生的气体通入酸性KMnO4溶液,紫色褪去 | 证明生成了乙烯 |
D | 将少量的溴水滴入NaI溶液中,再滴加CCl4,振荡、静置,溶液分为两层:上层溶液无色,下层溶液紫红色 | 氧化性:Br2>I2 |
 2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示: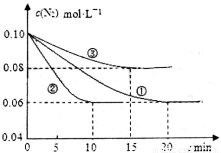
 H2O的电离平衡常数Kb=________________。
H2O的电离平衡常数Kb=________________。
 CO (g)+H2O(g) △H>0,达到平衡后,为提高该反应的速率和CO2的转化率,采取的正确措施是
CO (g)+H2O(g) △H>0,达到平衡后,为提高该反应的速率和CO2的转化率,采取的正确措施是
