题目内容
6.某烧碱样品含有少量不与酸作用的杂质,为了滴定其纯度,进行以下滴定操作:A.在250mL的容量瓶中配制250mL烧碱溶液
B.将250mL烧碱溶液置于锥形瓶中滴加几滴酚酞做指示剂
C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解
D.将物质的量浓度为C的标准盐酸溶液装入酸式滴定管,调整液面记下开始读数为V1mL
E.在锥形瓶下垫一张白纸,滴定至红色刚好消失为止,记下读数V2mL.回答下列问题:
(1)正确操作步骤的顺序是(填字母):C→A→B→D→E.(算一个空)
(2)滴定管读数时应注意滴定管垂直,液面不再变化时才可读数,视线与溶液凹液面最低点相平,读数准确到小数点后两位.
( 3)操作E中的锥形瓶下垫一张白纸的作用是是为了使颜色变化更为明显,易于判断滴定终点.
(4)操作D中液面应调整到,尖嘴部分应.
(5)某学生实验时把锥形瓶用烧碱溶液润洗,使测定的浓度偏高(填“偏高”.“偏低”或“无影响”)
(6)该烧碱样品纯度的计算式为w(NaOH)=$\frac{0.4C({V}_{2}-{V}_{1})}{W}$×100%.
分析 (1)实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,然后用标准液进行滴定;
(2)滴定管垂直,液面不再变化时才可读数,视线与溶液凹液面最低点相平,注意滴定管的精确值;
(3)锥形瓶下垫一张白纸使滴定终点颜色变化更明显,便于分辨;
(4)滴定管0刻度在上,滴定前应调节到“0“刻度或“0“刻度线以下,为减小误差,尖嘴部分应充满液体,无气泡;
(5)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(6)根据反应消耗的盐酸,根据关系式:HCl~NaOH求出氢氧化钠,进一步求出样品的纯度.
解答 解:(1)在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解,在250mL的容量瓶中配制250mL烧碱溶液,用移液管移取25mL烧碱溶液于锥形瓶中并滴加几滴酚酞做指示剂,将物质的量浓度为C的标准盐酸溶液装入酸式滴定管.调整液面记下开始读数为V1mL,在锥形瓶下垫一张白纸,滴定至红色刚好消失为止,记下读数V2mL,故正确的操作顺序为:C→A→B→D→E;
故答案为:C;A;B;E;
(2)滴定管垂直,液面不再变化时才可读数,视线与溶液凹液面最低点相平,读数准确到小数点后两位;
故答案为:滴定管垂直,液面不再变化时才可读数,视线与溶液凹液面最低点相平,读数准确到小数点后两位;
(3)锥形瓶下垫一张白纸使滴定终点颜色变化更明显,便于分辨,方法是垫一张白张是为了使颜色变化更为明显,易于判断滴定终点;
故答案为:是为了使颜色变化更为明显,易于判断滴定终点;
(4)滴定管0刻度在上,滴定前应调节到“0“刻度或“0“刻度线以下,为减小误差,尖嘴部分应充满液体,无气泡,
故答案为:调节到零刻度或零稍下的某一刻度;充满标准盐酸溶液;
(5)某学生实验时把锥形瓶用烧碱溶液润洗,待测液的物质的量偏大,造成V(标准)偏高,c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏高;
故答案为:偏高;
(6)滴到消耗的盐酸n(盐酸)=cV=(V2-V1)×10-3L×Cmol/L,根据反应方程可知,n(NaOH)=n(盐酸)=C(V2-V1)×10-3mol,
所以原来样品中氢氧化钠的物质的量为:C(V2-V1)×10-3mol,则样品中氢氧化钠的质量为m(NaOH)=nM=C(V2-V1)×10-3mol×40g/mol=0.4C(V2-V1)g,则该烧碱样品的纯度为:$\frac{0.4C({V}_{2}-{V}_{1})g}{Wg}$×100%=$\frac{0.4C({V}_{2}-{V}_{1})}{W}$×100%;
故答案为:$\frac{0.4C({V}_{2}-{V}_{1})}{W}$×100%.
点评 本题综合考查酸碱中和滴定,侧重于化学实验基本操作以及物质的含量的测定等问题,题目难度中等,建议在学习中把握相关基本实验方法,学习中注意积累.

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 的有机物分子1mol,与NaOH溶液混合并水浴加热,完全反应后,消耗NaOH的物质的量为( )
的有机物分子1mol,与NaOH溶液混合并水浴加热,完全反应后,消耗NaOH的物质的量为( )| A. | 1mol | B. | 2mol | C. | 3mol | D. | 4mol |
2.1 g平均相对分子质量为7.2的CO与H2组成的混合气体在足量的O2中充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加( )
A.2.1 g B.3. 6 g C.7.2 g D.无法确定
 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化.直到溶液颜色由红色突变为无色,且半分钟内不褪色为止.
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是D.
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
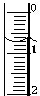
(3)若滴定开始和结束时,酸式滴定管中的液面如图1和图2所示,请将数据填入表格的空白处.
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L 盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.10 | 26.10 |
| 第二次 | 25.00 | 1.56 | 28.08 | 26.52 |
| 第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
 某化学兴趣小组使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
某化学兴趣小组使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).一.实验步骤:
(1)配制100mL待测白醋溶液.量取10.00mL食用白醋,注入烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得.
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
(3)读取盛装0.1000 mol/L NaOH 溶液的碱式滴定管(填仪器名称)的初始读数.如果液面位置如图所示,则此时的读数为0.70mL.
(4)滴定.当溶液由无色恰好变为红色,且半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
二.实验记录:
| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(5)市售白醋总酸量=4.500g/100mL.
| A. | 0.1 mol•L-1NaNO3溶液:H+、Fe2+、Cl-、SO42-、K+ | |
| B. | $\frac{{K}_{W}}{c({H}^{+})}$=10-13mol•L-1的溶液:Na+、AlO2-、OH-、NO3- | |
| C. | 0.1 mol•L-1NH3•H2O溶液:K+、Na+、NO3-、C1- | |
| D. | 加入铝粉能产生大量H2的溶液:Na+、K+、Cl-、HCO3- |
| A. | 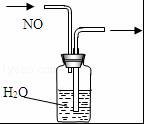 排水集气法收集NO | B. | 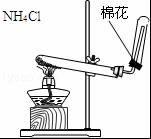 实验室制取氨气 | ||
| C. | 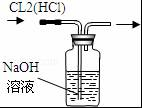 除去氯气中的氯化氢 | D. |  分离碘酒中的碘和酒精 |
