题目内容
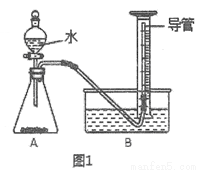
11.DIS(Digital Information System)系统即数字化信息系统,它由传感器、数据采集器和计算机组成.DIS系统为化学教学提供了全新的技术手段和教学平台.某学习小组用DIS系统测定食用白醋中醋酸的物质的量浓度,以溶液的导电能力来判断滴定终点.实验步骤如下:(1)用(图1)酸式滴定管(填仪器名称)量取10.00mL食用白醋,在烧杯(填仪器名称)中用
水稀释后转移到100mL容量瓶(填仪器名称)中定容,然后将稀释后的溶液倒入试剂瓶中.
(2)量取20.00mL上述溶液倒入烧杯中,连接好DIS系统(如图1),向烧杯中滴加浓度为0.1000mol•L-1的氨水,计算机屏幕上显示出溶液导电能力随氨水体积变化的曲线(见图2).
①用滴定管盛氨水前,滴定管要用0.1000mol•L-1的氨水润洗2~3遍,润洗的目的是防止氨水被稀释.
②溶液导电能力随氨水体积变化的原因是醋酸为弱电解质,开始导电性不强,滴入稀氨水,反应生成醋酸铵,为强电解质,离子浓度增大,导电性增强,继续滴入氨水,体积变大,离子浓度减小,导电性又逐渐减弱.
③食用白醋中醋酸的物质的量浓度是1.000mol•L-1.

分析 (1)根据量取液体体积的精确度以及液体的性质选择仪器;在烧杯中稀释溶液;用容量瓶配制一定浓度的溶液;
(2)①滴定管清洗完之后管壁上残留水,会使待测溶液浓度下降;
②由图象上可知随氨水体积的增大,导电性先增大后减小,结合醋酸与氨水反应过程分析解答;
③根据图表可知当混合液导电能力最强时,醋酸恰好与氨水反应完全,分别求出反应消耗的醋酸的物质的量和氨水的物质的量,依据酸碱中和反应n(CH3COOH)=n(NH3•H2O)计算求解.
解答 解:(1)滴定管精确度为0.01ml,醋酸具有酸性能腐蚀橡胶管,所以应选用酸式滴定管量取白醋;然后把白醋,转移到烧杯中加水稀释溶液,再把溶液转入100mL容量瓶中中定容;
故答案为:酸式滴定管;烧杯;容量瓶;
(2)①为防止滴定管清洗完之后管壁上残留水将待测液稀释,应用所盛0.1000mol•L-1的氨水润洗2-3次,
故答案为:0.1000mol•L-1的氨水;防止氨水被稀释;
②醋酸为弱电解质,开始导电性不强,滴入稀氨水,反应生成醋酸铵,为强电解质,离子浓度增大,导电性增强,继续滴入氨水,体积变大,离子浓度减小,导电性又逐渐减弱;
故答案为:醋酸为弱电解质,开始导电性不强,滴入稀氨水,反应生成醋酸铵,为强电解质,离子浓度增大,导电性增强,继续滴入氨水,体积变大,离子浓度减小,导电性又逐渐减弱;
③设白醋的浓度为C,则反应消耗的醋酸的物质的量为n(CH3COOH)=C×10.00mL×$\frac{20}{100}$;反应消耗的氨水的物质的量为:n(NH3•H2O)=0.1000mol•L-1×20ml,根据图表可知当混合液导电能力最强时,醋酸恰好与氨水反应完全,所以n(CH3COOH)=n(NH3•H2O),即C×10.00mL×$\frac{20}{100}$=0.1000mol•L-1×20ml,C=1.000mol•L-1;
故答案为:1.000mol•L-1.
点评 本题考查溶液的配制、中和滴定实验,题目难度中等,注意滴定管的选择和使用的注意事项,溶液的导电性取决于溶液中离子的浓度,侧重于考查学生的实验操作能力.

 华东师大版一课一练系列答案
华东师大版一课一练系列答案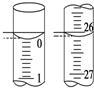 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂.请填写下列空白:(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直到因加入一滴盐酸后,溶液由黄色变为橙色,并半分钟内不复原为止.
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是D(填字母序号).
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
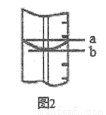
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为26.10mL.
(4)某学生根据3次实验分别记录有关数据如表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
 二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作做冷剂等,对臭氧层无破坏作用.工业上以水煤气(CO、H2)为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作做冷剂等,对臭氧层无破坏作用.工业上以水煤气(CO、H2)为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:2H2(g)+CO(g)?CH3OH(g)△H=-90.0kJ.mol-1 ①
2CH3OH(g)?CH3OCH(g)+H2O (g)△H=-24.5kJ.mol-1②
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.1kJ.mol-1③
回答下列问题:
(1)新工艺的总反应3H2+3CO?CH3OCH3+CO2的热化学方程式为3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-245.6kJ/mol.
(2)已知一些共价键的键能如下:
| 化学键 | H-H | C-H | C-O | O-H |
| 键能(kJ.mol-1 | 436 | 414 | 326 | 464 |
(3)在250℃恒容密闭容器中,下列事实可以说明反应③已达平衡的是(填选项字母)BC.
A.容器内气体密度保持不变
B.CO与CO2的物质的量之比保持不变
C.H2O与CO2的生成速率之比为1:1
D.该反应的平衡常数保持不变
(4)某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K=2.042.
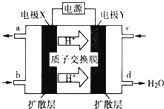
(5)绿色电源“二甲醚-氧气燃料电池”的工作原理如图所示.
①氧气应从C处通入,电极Y为正极,发生的电极反应式为O2+4e-+4H+═2H2O;
②二甲醚(CH3)2O应从b处加入,电极X上发生的电极反应式为(CH3)2O-12e-+3H2O=2CO2+12H+;
③电池在放电过程中,电极X周围溶液的pH减小 (填“增大”“减小”或“不变”).
 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:氢氧化钠少量时2NH4HSO4+2NaOH═(NH4)2SO4+Na2SO4+2H2O
氢氧化钠过量时NH4HSO4+2NaOH═Na2SO4+NH3↑+2H2O
(1)同学们设计的实验装置图如图,请回答相关问题.
①装置中碱石灰的作用是吸收氨气中的水蒸气.
②广口瓶内四氯化碳的作用是防止倒吸.
③指导老师指出,用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外逸,测得的样品含氮量仍将偏低,其原因可能是残留在反应装置中的氨气未被稀硫酸吸收.
(2)同学们改进实验装置后(改进装置图略),进行如下实验.
称取不同质量的上述样品分别与40.00mL相同浓度的氢氧化钠溶液混合,完全溶解后,加热充分反应(此温度下铵盐不分解),并使生成的氨气全部被稀硫酸吸收,测得氨气的质量.部分实验数据如表:
| 氢氧化钠溶液体积/mL | 40.00mL | ||
| 样品质量/g | 7.750 | 15.50 | 23.25 |
| 氨气质量/g | 1.870 | 1.870 | 1.700 |
①样品中氮元素的质量分数是19.87%.
②所用氢氧化钠溶液的物质的量浓度为3.25 mol/L.
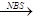 CH3CHBrCH=CH2
CH3CHBrCH=CH2
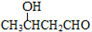 、
、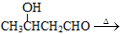 CH3CH=CHCHO+H2O
CH3CH=CHCHO+H2O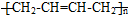 )的合成路线:___________________________。
)的合成路线:___________________________。
 .
.