题目内容
氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH3,放出92.4 kJ热量。
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q 184.8kJ(填“>”、“<”或“=”)。一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是 。
a.3v逆(N2)=v正(H2) b.2v正(H2)= v正(NH3)
c.混合气体密度保持不变 d.c(N2):c(H2):c(NH3)=1:3:2
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为
2NH3 (g)+ CO2 (g) CO(NH2)2 (l)+ H2O (l)。
CO(NH2)2 (l)+ H2O (l)。
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)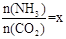 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
(3)图中的B点处,NH3的平衡转化率为 。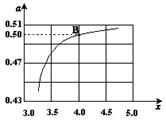
(4)已知: 3Cl2+2NH3→N2+6HCl ――① 3Cl2+8NH3→N2+6NH4Cl ――②
完成并配平下列氧化还原反应方程式:12Cl2+15NH3→ ――③
(1)< a (共4分,各2分)
(2)c(NH3)增大,平衡正向移动,所以CO2的转化率增大 (2分)
(3)25% (2分)
(4)12Cl2+15NH3→ 4 N2+ 7 NH4Cl + 17 HCl (2分)
解析试题分析:(1)根据题给信息知,合成氨反应的热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,合成氨的反应是可逆反应不能进行彻底,该温度下合成塔中放入2mol N2和6mol H2,生成的氨气小于2mol,故达平衡后放出的热量小于184.4 kJ;一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是 a.3v逆(N2)=v正(H2),符合v正= v逆,正确;b.2v正(H2)= v正(NH3)两个反应速率均为正反应速率,错误;c.混合气体密度不随反应的进行而变化,不能作为平衡状态的依据,错误;d.平衡时c(N2):c(H2):c(NH3)不一定为1:3:2,错误;选a;(2)根据题给图像及信息分析,CO2平衡转化率(α)随着x增大而增大的原因是c(NH3)增大,平衡正向移动,所以CO2的转化率增大;(3)B点处x=4,原料气中的NH3和CO2的物质的量之比为4,二氧化碳转化率为50%,假设氨气为4mol,二氧化碳为1mol,则反应的二氧化碳为0.50mol,依据化学方程式2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l)知,参加反应的氨气为1.00mol,NH3的平衡转化率为25%;(4)根据题给信息及氧化还原方程式的书写原则写出该反应的化学方程式为:12Cl2+15NH3→ 4 N2+ 7 NH4Cl + 17 HCl 。
CO(NH2)2(l)+H2O(l)知,参加反应的氨气为1.00mol,NH3的平衡转化率为25%;(4)根据题给信息及氧化还原方程式的书写原则写出该反应的化学方程式为:12Cl2+15NH3→ 4 N2+ 7 NH4Cl + 17 HCl 。
考点:考查反应热的计算、可逆反应的特点、平衡标志及平衡图像、平衡计算及氧化还原方程式的书写。

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案氮氧化物是大气污染物之一,消除氮氧化物的方法有多种。
(1)利用甲烷催化还原氮氧化物。已知:
①CH4 (g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H =-574 kJ/mol
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H =-1160 kJ/mol
则CH4 将NO2 还原为N2 的热化学方程式为: 。
(2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。 反应的化学方程式为: 为提高氮氧化物的转化率可采取的措施是 (写出1条即可)。
为提高氮氧化物的转化率可采取的措施是 (写出1条即可)。
(3)利用ClO2氧化氮氧化物。其转化流程如下: NO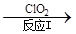 NO2
NO2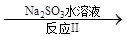 N2。已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O =NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是 ;若生成11.2 L N2(标准状况),则消耗ClO2 g 。
N2。已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O =NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是 ;若生成11.2 L N2(标准状况),则消耗ClO2 g 。
(4)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g) N2 (g)+CO2 (g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g)+CO2 (g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度/mol?L-1/ 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
①T1℃时,该反应的平衡常数K= (保留两位小数).②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 .③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H 0(填“>”、“=”或“<”).
2013年底,上海青浦发生一家三口误食亚硝酸盐造成两男孩身亡的惨剧。常见的亚硝酸盐主要是亚硝酸钠(NaNO2),它是一种白色不透明晶体,虽然形状很像食盐,而且有咸味,但有毒。亚硝酸钠和氯化钠的部分资料如下表:
| | 亚硝酸钠(NaNO2) | 氯化钠(NaCl) |
| 水溶性 | 易溶,溶液呈弱碱性 | 易溶,溶液呈中性 |
| 熔点 | 271℃ | 801℃ |
| 沸点 | 320℃会分解 | 1413℃ |
| 跟稀盐酸作用 | 有红棕色的NO2气体放出 | 无反应 |
(1)氮元素最外层电子排布式为________,氮原子核外电子共占据了___个轨道。亚硝酸钠中各元素原子半径由大到小依次为_________,亚硝酸的电离方程式为:_______________________。
(2)亚硝酸盐中毒是因为亚硝酸盐可将正常的血红蛋白氧化成高铁血红蛋白,即血红蛋白中的铁元素由二价变为三价,失去携氧能力,使组织出现缺氧现象.美蓝是亚硝酸盐中毒后的有效解毒剂.下列说法不正确的是( )
A.高铁血红蛋白的还原性比亚硝酸盐弱
B.药品美蓝应具有还原性
C.中毒时亚硝酸盐发生还原反应
D.解毒时高铁血红蛋白被还原
(3)NaNO2有毒,将含该物质的废水直接排放会引起水体的严重污染,所以这种废水必须处理后才能排放。处理方法之一:在酸性条件下, NaNO2与KI的物质的量为1:1时恰好完全反应,且I-被氧化为I2,此时产物中含氮的物质(A)为________(填化学式)。若利用上述方法制A,现有两种操作步骤:①先将废水酸化后再加KI;②先将KI酸化后再加入废水。哪种方法较好?____(填序号。假设废水中其它物质不反应)
(4)如要鉴别亚硝酸钠和氯化钠固体,下列方法不可行的是
A.观察并比较它们在水中的溶解速度 B.测定它们各自的熔点
C.在它们的水溶液中滴加甲基橙 D.在酸性条件下加入KI淀粉试液
 CH3OH(g)+H2O(g) ΔH。
CH3OH(g)+H2O(g) ΔH。