题目内容
A、B、X、Y、Z、W六种短周期主族元素,A是地壳中含量最多的金属元素,短周期主族元素中B的原子半径最大,X、Y、Z、W元素在周期表中的相对位置如下图所示,其中Z元素原子最外层电子数是电子层数的2倍。请回答下列
问题: 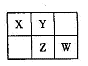
(1)W的最高价氧化物化学式是 ;Z的原子结构示意图为 。
(2)A、B各自最高价氧化物对应的水化物反应的化学方程式为 。
(3)AW3可用于净水,其原理是 。(请用离子方程式表示)
(4)工业合成X的简单气态氢化物是放热反应。下列措施中既能提高
反应速率,又能提高原料转化率的是 。
a.升高温度
b.加入催化剂
c.将X的简单气态氢化物及时移离
d.增大反应体系的压强
(5)标准状况下,2.24L X的简单气态氢化物被200 mL l mol L-1X的最高价氧化物对应的水化物溶液吸收后,所得溶液中离子浓度从大到小的顺序是(用离子符号表示) 。
(6)WY2在杀菌消毒的同时,可将剧毒氰化物氧化成无毒气体而除去,写出用WY2(沸点9.9℃)氧化除去CN-的离子方程式 。
(1)Cl2O7 
(2)Al(OH)3+NaOH=NaAlO2+2H2O
(3)Al3++3 H2O  Al(OH)3+3H+
Al(OH)3+3H+
(4)d
(5)NO3-、H+、NH4+、OH-
(6)2ClO2+2CN-=N2+2Cl-+2CO2
解析A是地壳中含量最多的金属元素,则A是Al;短周期中B的原子半径最大,B是Na;Z是最外层电子数是电子层的3倍,Z则是S,X、Y、W依次是N、O、Cl。
(1)W的最高价氧化物是Cl2O7;Z原子结构示意图为 ;
;
(2)反应方程式为Al(OH)3+NaOH=NaAlO2+2H2O
(3)AlCl3净水原理是,Al3+发生水解,Al3++3 H2O  Al(OH)3+3H+ ;
Al(OH)3+3H+ ;
(4)提高转化率又能提高反应速率,选d。
(5)0.1mol NH3被0.2mol HNO3的溶液吸收后,是0.1molNH4NO3和0.1molHNO3组成的,由于NH4+能发生水解,离子浓度由大到小顺序为NO3-、H+、NH4+、OH-。
(6)2ClO2+2CN-=N2+2Cl-+2CO2

已知5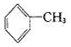 +6KMnO4+9H2SO4=3K2SO4+6MnSO4+14H2O+_______。
+6KMnO4+9H2SO4=3K2SO4+6MnSO4+14H2O+_______。
下列说法不正确的是
A.氧化产物为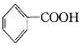 | B. 作氧化剂 作氧化剂 |
| C.每1mol KMnO4转移5mol e- | D.H2SO4起酸的作用 |
I. 今有H2、Cl2混合气100 mL(标况),其中一种气体的体积为45mL。光照使两种气体发生反应后恢复到标况,气体体积为 mL。为了说明反应后气体中H2或Cl2有剩余,使气体通过10 mL水,并使剩余气体干燥后恢复到标况,
(1)若仍剩余___mL,证明有___剩余,理由是_____;
(2)若溶液有___性质,证明有___剩余,理由是________________________。
II.一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧化性强弱的微型装置(如图所示)。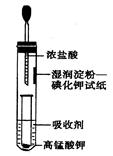
(1)下列溶液能吸收Cl2的是________。
| A.饱和食盐水 | B.Na2SO4溶液 |
| C.NaOH溶液 | D.浓硫酸 |
(3)实验室制取氯气的离子方程式__________________________。
 CO(NH2)2 (l)+ H2O (l)。
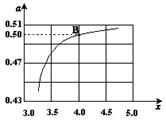
CO(NH2)2 (l)+ H2O (l)。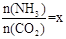 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。