题目内容
8.第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.010mol•L-1的这四种溶液pH与该元素原子半径的关系如右图所示.下列说法正确的是( )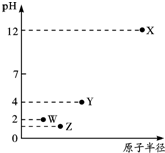
| A. | 简单离子半径:X>Y>Z>W | |
| B. | Y元素存在同素异形体 | |
| C. | 气态氢化物的稳定性:Z>W>Y | |
| D. | X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性 |
分析 第三周期元素中,X最高价氧化物水化物的溶液pH为12,氢氧根浓度为0.01mol/L,故为一元强碱,则X为Na;Y、W、Z对应的最高价氧化物水化物的溶液pH均小于7,均为酸,W最高价含氧酸溶液中氢离子浓度为0.01mol/L,故为一元强酸,则W为Cl元素;最高价含氧酸中,Z对应的酸性比W的强、Y对应的酸性比W的弱,而原子半径Y>Z>Cl,硅酸不溶于水,故Z为S元素,Y为P元素,据此解答.
解答 解:第三周期元素中,X最高价氧化物水化物的溶液PH为12,氢氧根浓度为0.01mol/L,故为一元强碱,则X为Na;Y、W、Z对应的最高价氧化物水化物的溶液PH均小于7,均为酸,W最高价含氧酸溶液中氢离子浓度为0.01mol/L,故为一元强酸,则W为Cl元素;最高价含氧酸中,Z对应的酸性比W的强、Y对应的酸性比W的弱,而原子半径Y>Z>Cl,硅酸不溶于水,故Z为S元素,Y为P元素.
A.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径P3->S2->Cl->Na+,故A错误;
B.Y为磷元素,单质有红磷、白磷,故B正确;
C.非金属性W(Cl)>Z(S)>Y(P),气态氢化物的稳定性:W>Z>Y,故C错误;
D.X和Y的最高价氧化物对应的水化物分别为NaOH、磷酸,恰好中和生成磷酸钠,溶液中磷酸根水解,溶液呈碱性,故D错误,
故选B.
点评 本题考查结构性质位置关系应用,根据酸性、原子半径推断元素是解题关键,侧重对元素周期律的考查,难度中等.

练习册系列答案
相关题目
16.下列物质的核磁共振氢谱图中,有4个吸收峰的是( )
| A. | 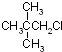 | B. | 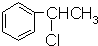 | C. | 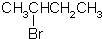 | D. |  |
3.设NA为阿伏加德罗常数.下列说法错误的是( )
| A. | 一定条件下2 mol SO2和1 mol O2充分反应后,混合气体的分子总数大于2NA | |
| B. | 常温常压下,64 g O2和O3混合气体中含有原子总数为4NA | |
| C. | 1mol Cl2与NaOH溶液反应,转移的电子总数为2NA | |
| D. | 标准状况下,22.4L N2含共用电子对数为3NA |
18.下列对合成材料的认识不正确的是( )
| A. | 有机高分子化合物称为聚合物或高聚物,是因为它们大部分是由小分子通过聚合反应而制得的 | |
| B. |  的单体是HOCH2OH与 的单体是HOCH2OH与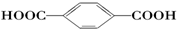 | |
| C. | 聚乙烯( )是由乙烯加聚生成的纯净物 )是由乙烯加聚生成的纯净物 | |
| D. | 高分子材料可分为天然高分子材料和合成高分子材料两大类 |
 ,黄绿色固体:
,黄绿色固体: ;
; H2O
H2O CO2
CO2 .
. .
.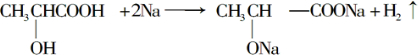 .
.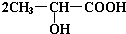 +Na2CO3→
+Na2CO3→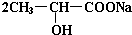 +H2O+CO2↑.
+H2O+CO2↑. .
.