题目内容
14. 某温度时,在0.5L密闭容器中,某一反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析求得:
某温度时,在0.5L密闭容器中,某一反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析求得:(1)该反应的化学方程式为2A?B;
(2)若降低温度,则v (正)减慢,v (逆)减慢;(填“加快”“减慢”或“不变”)
(3)第4min时,正、逆反应速率的大小关系为:v (正)> v (逆);(填“>”、“<”或“=”,下同)
(4)以下措施能加快反应速率的是BD.
A.恒温恒容充入He使压强增大 B.缩小体积,使压强增大
C.恒温恒压充入He D.平衡后加入催化剂.
分析 由图可知,从反应开始,A的物质的量减少,B的物质的量增加,则A为反应物、B为生成物,开始至4min时,A减少0.8mol-0.4mol=0.4mol,B增加0.4mol-0.2mol=0.2mol,第8min时A、B的物质的量不再变化,达到平衡状态,以此来解答.
解答 解:(1)由图可知,从反应开始,A的物质的量减少,B的物质的量增加,则A为反应物、B为生成物,开始至4min时,A减少0.8mol-0.4mol=0.4mol,B增加0.4mol-0.2mol=0.2mol,由反应速率之比等于化学计量数之比可知,A、B的化学计量数比为2:1,且后来达到平衡状态,则反应为2A?B,
故答案为:2A?B;
(2)降低温度,正逆反应速率都减慢,故答案为:减慢;减慢;
(3)第4min时,A的物质的量仍在减少,为正反应阶段,正、逆反应速率的大小关系为:v(正)>v(逆),故答案为:>;
(4)A.恒温恒容充入He使压强增大,参加反应的气体的浓度不变,在反应速率不变,故A错误;
B.缩小体积,使压强增大,参加反应气体的浓度增大,故B正确;
C.恒温恒压充入He,体积增大,参加反应气体的浓度减小,反应速率减小,故C错误;
D.平衡后加入催化剂,反应速率增大,故D正确.
故答案为:BD.
点评 本题考查物质的量随时间变化曲线,为高频考点,把握图象中物质的量的变化、平衡状态的判断、速率比较等为解答的关键,侧重分析与应用能力的考查,注意速率的比较,题目难度不大.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
5.已知2SO2(g)+O2(g)?2SO3(g)(正反应方向放热).若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法正确的是( )
| A. | 若降低温度,可以加快反应速率 | |
| B. | 增大O2浓度可以增大反应速率 | |
| C. | 随着反应的进行,正反应速率逐渐减小,最后变为0 | |
| D. | 达到化学平衡状态时,SO2和SO3的浓度一定相等 |
9. 如图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B原子的质量数.B原子核内质子数和中子数相等.下列叙述不正确的是( )
如图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B原子的质量数.B原子核内质子数和中子数相等.下列叙述不正确的是( )
 如图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B原子的质量数.B原子核内质子数和中子数相等.下列叙述不正确的是( )
如图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B原子的质量数.B原子核内质子数和中子数相等.下列叙述不正确的是( )| A. | C元素是非金属性最强的元素 | |
| B. | A元素最高价氧化物对应的水化物具有强氧化性 | |
| C. | 三种元素的原子半径的大小顺序是:B>C>A | |
| D. | B元素的氧化物、氢化物的水溶液都呈酸性 |
 )是一种定香剂,以芳香醇A为原料合成H的一种流程如下:
)是一种定香剂,以芳香醇A为原料合成H的一种流程如下:
 (R1、R表示氢原子或烃基)
(R1、R表示氢原子或烃基) ;E的官能团名称是碳碳双键、羧基.
;E的官能团名称是碳碳双键、羧基. .
. 、
、 .
. (其他试剂自选).
(其他试剂自选). 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图.
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图.
 碳、镁、镍在工业生产和科研领域有广泛用途.请回答下列问题:
碳、镁、镍在工业生产和科研领域有广泛用途.请回答下列问题: )等.
)等. 是常用的分析试剂.其中位于同周期的三种基态原子第一电离能由小到大的顺序为C<O<N(用元素符号表示);这三种元素形成的一种离子与CS2互为等电子体,该离子符号为OCN-.
是常用的分析试剂.其中位于同周期的三种基态原子第一电离能由小到大的顺序为C<O<N(用元素符号表示);这三种元素形成的一种离子与CS2互为等电子体,该离子符号为OCN-.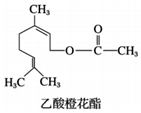 乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是( )