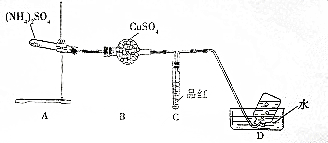
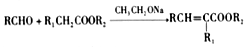题目内容
5.在一密封容器中盛有0.8mol Na2O2与1mol NaHCO3,将其加热到300℃,经充分反应后,容器内残留的固体是( )| A. | 0.5mol Na2CO3和1mol NaOH | B. | 1mol Na2CO3和0.6mol NaOH | ||
| C. | 0.8mol Na2CO3和1mol NaOH | D. | 只有1mol Na2CO3 |
分析 混合物在密闭容器中加热,可能发生如下反应:
①2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2,
②2Na2O2+2CO2═2Na2CO3+O2,
③2Na2O2+2H2O═4NaOH+O2,
④2NaOH+CO2═Na2CO3+H2O,
由上述反应,可得总的反应方程式为:
Ⅰ、2Na2O2+4NaHCO3=4Na2CO3+O2↑+2H2O↑
Ⅱ、2Na2O2+2NaHCO3=2Na2CO3+O2↑+2NaOH
由于1<n(NaHCO3):n(Na2O2)=1:0.8=1.25<2,故Ⅰ、Ⅱ总反应都发生,根据碳原子、钠原子守恒计算Na2CO3、NaOH的物质的量.
解答 解:混合物在密闭容器中加热,可能发生如下反应:
①2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2,
②2Na2O2+2CO2═2Na2CO3+O2,
③2Na2O2+2H2O═4NaOH+O2,
④2NaOH+CO2═Na2CO3+H2O,
由上述反应,可得总的反应方程式为:
Ⅰ、2Na2O2+4NaHCO3=4Na2CO3+O2↑+2H2O↑
Ⅱ、2Na2O2+2NaHCO3=2Na2CO3+O2↑+2NaOH
由于1<n(NaHCO3):n(Na2O2)=1:0.8=1.25<2,故Ⅰ、Ⅱ总反应都发生,容器内残留的固体是:Na2CO3、NaOH,
设Na2CO3、NaOH的物质的量分别为xmol、ymol,
根据碳原子守恒n(Na2CO3)=n(NaHCO3)=1mol,根据钠原子守恒:n(NaOH)=0.8mol×2+1mol-1mol×2=0.6mol,
故选:B.
点评 本题考查混合物的有关计算,难度较大,注意利用总反应方程式分段讨论,由于二氧化碳与氢氧化钠反应,故可以认为过氧化钠先与二氧化碳反应,反应完毕过氧化钠有剩余再与水反应,据此分段书写总反应式.

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案| A. | 0.1 mol•L-1的NH4Cl溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)>c(Cl-) | |
| C. | 已知Ka(HF)=7.2×10-4,Ka(HCN)=6.2×10-10,等体积等浓度的NaF、NaCN溶液中,前者离子总数小于后者 | |
| D. | 浓度均为0.1 mol•L-1的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为:①>②>③ |
| A. | 安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 | |
| B. | 二氧化氯和三氯化铁都常用于自来水的处理,二者的作用原理是不相同的 | |
| C. | 煤经气化和液化两个物理变化过程,可变为清洁能源 | |
| D. | 乙醇、糖类和蛋白质都是人体必需的营养物质 |
| A. | 卤素离子(X-)只有还原性而无氧化性 | |
| B. | 某元素由化合态变成游离态,该元素一定被氧化 | |
| C. | 失电子难的原子获得电子的能力一定强 | |
| D. | 卤素最高价氧化物的分子式都为X2O7 |