题目内容
8.下列实验操作中:①过滤②蒸发结晶③溶解④取液体试剂⑤取固体试剂⑥配制一定物质的量浓度的溶液.一定要用到玻璃棒的是( )| A. | ①②③⑥ | B. | ④⑤ | C. | ①④⑥ | D. | ①③⑤⑥ |
分析 过滤需要玻璃棒引流,蒸发利用玻璃棒搅拌,溶解固体需玻璃棒搅拌加速溶解,配制溶液转移液体需要玻璃棒,以此来解答.
解答 解:①过滤时要用玻璃棒引流;
②蒸发要用玻璃棒搅拌防止局部受热造成液滴飞溅同时能加速溶解;
③溶解固体需玻璃棒搅拌加速溶解;
④取液体试剂直接倾倒不需要玻璃棒;
⑤取用固体用药匙,不用玻璃棒;
⑥一定物质的量浓度溶液的配制,需要玻璃棒转移液体;
故选A.
点评 本题考查了实验基本操作的使用仪器和操作步骤,熟悉实验操作即可解答,较简单.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案
相关题目
13.短周期元素X、Y、Z、R的原子序数依次增大,它们的原子核外L层电子数依次为7、8、8、8,Y的电子层数等于最外层电子数,Z的最高正价和最低负价之和等于0,R原子获得2个电子后核外电子数等于氩原子的电子数.下列说法正确的是( )
| A. | 单质的熔点:Y>Z>X | B. | 简单氢化物的稳定性:X>R>Z | ||
| C. | 简单离子半径:Y>R>X | D. | X与其他3种元素都组成离子化合物 |
3.下列物质按纯净物、混合物、电解质、非电解质的顺序组合的一组为( )
| A. | 冰水共存物、空气、氨水、二氧化硫 | B. | 胆矾、盐酸、硫酸钠、干冰 | ||
| C. | 生铁、福尔马林、浓硫酸、碳酸钙 | D. | 碱石灰、漂白粉、氧化钠、硫酸钡 |
13.下列关于铵盐的叙述中正确的是( )
①所有铵盐中.氮元素化合价都是一3价
②所有铵盐都易溶于水
③铵态氮肥贫不宜与碱性肥料混合使用
④铵盐都是由离子构成的化合物
⑤铵盐都能与碱反应,不能与酸反应
⑥铵盐受热分解一定都会产生氨气.
①所有铵盐中.氮元素化合价都是一3价
②所有铵盐都易溶于水
③铵态氮肥贫不宜与碱性肥料混合使用
④铵盐都是由离子构成的化合物
⑤铵盐都能与碱反应,不能与酸反应
⑥铵盐受热分解一定都会产生氨气.
| A. | ①③④ | B. | ②③④ | C. | ①②③④⑥ | D. | ①②③④⑤⑥ |
17.将某些化学知识用图象表示,可以收到直观、简明的效果.下列图象所表示的化学知识中,
明显不正确的是( )
明显不正确的是( )
| A. | 分散系的分类 | B. |  稀释浓氢氧化钠溶液的过程 | ||
| C. |  向碳酸钠溶液中逐滴滴加盐酸 | D. |  向偏铝酸钠溶液中逐滴滴加盐酸 |
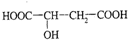 .
.
 常温下,A是双原子分子气态单质,其密度为3.17g/L(标准标况下),B、C、D都是含A元素的化合物,转化关系如图所示:
常温下,A是双原子分子气态单质,其密度为3.17g/L(标准标况下),B、C、D都是含A元素的化合物,转化关系如图所示: