题目内容
下列物质酸大小比较正确的是( )
| A、H2SO4>CH3COOH |
| B、HClO3>HClO4 |
| C、H3PO4>HNO3 |
| D、H2CO3<HClO |
考点:元素周期律的作用
专题:元素周期律与元素周期表专题
分析:元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;同种元素的物质间元素的化合价越高,对应的含氧酸的酸性越强.
解答:
解:A、H2SO4是强酸,而CH3COOH是弱酸,所以H2SO4>CH3COOH,故A正确;
B、HClO3中非羟基氧为数目为2,而高氯酸中非羟基氧为数目为3,非羟基氧的数目越多酸性越强,所以HClO3<HClO4,故B错误;
C、周主族元素从上往下非金属性减弱,所以N的非金属性强P,则最高价氧化物对应水化物的酸性,H3PO4是弱酸,而HNO3是强酸,所以HNO3>H3PO4,故C错误;
D、漂白粉暴在空气中会变质,是空气中的二氧化碳与次氯酸钙反应,强酸制弱酸,所以H2CO3>HClO,故D错误;
故选A.
B、HClO3中非羟基氧为数目为2,而高氯酸中非羟基氧为数目为3,非羟基氧的数目越多酸性越强,所以HClO3<HClO4,故B错误;
C、周主族元素从上往下非金属性减弱,所以N的非金属性强P,则最高价氧化物对应水化物的酸性,H3PO4是弱酸,而HNO3是强酸,所以HNO3>H3PO4,故C错误;
D、漂白粉暴在空气中会变质,是空气中的二氧化碳与次氯酸钙反应,强酸制弱酸,所以H2CO3>HClO,故D错误;
故选A.
点评:本题考查元素周期律知识,难度不大,注意对应含氧酸的酸性与元素非金属性的强弱以及元素化合价的关系.

练习册系列答案
相关题目
含有0.20mol碳酸钠的溶液和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
| A、2.0mol/L |
| B、1.5 mol/L |
| C、0.18 mol/L |
| D、0.24mol/L |
下列电离方程式正确的是( )
| A、CH3COOH=CH3COO-+H+ |
| B、H2SO4=2H++SO42- |
| C、Ba(OH)2=Ba2++(OH-)2 |
| D、KHCO3=K++H++CO32- |
下列离子方程式书写错误的是( )
| A、在蓝色的淀粉溶液中通入足量SO2后成无色溶液:I2+SO2+2H2O=2I-+SO42-+4H+ |
| B、饱和Na2CO3溶液中通入CO2足量:2Na++CO32-+CO2+H2O=2NaHCO3↓ |
| C、钠投入CuSO4溶液中:2Na+Cu2++2H2O=2Na++Cu(OH)2↓+H2↑ |
| D、向酸性KMnO4溶液中加入H2O2:2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O |
能正确表示下列反应的离子方程式的是( )
| A、将鸡蛋壳在醋酸中溶解有气泡产生:CaCO3+2H+=Ca2++H2O+CO2↑ |
| B、CuSO4溶液中加入少量Ba(OH)2溶液:SO42-+Ba2+=BaSO4 |
| C、将Cu丝插入AgNO3溶液中:Cu+Ag+=Cu2++Ag |
| D、用小苏打NaHCO3治疗胃酸过多:HCO3-+H+=H2O+CO2↑ |
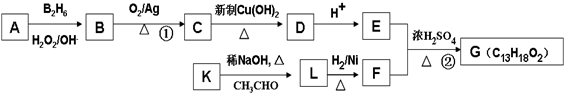

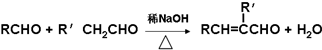
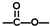 ”结构的共有
”结构的共有