题目内容
下列有关元素及其化合物性质的比较正确的是( )
| A、原子半径:F<O<Al |
| B、稳定性:H2O<PH3<NH3 |
| C、酸性:H2CO3<H2SO4<H3PO4 |
| D、碱性:LiOH<NaOH<Al(OH)3 |
考点:微粒半径大小的比较,金属在元素周期表中的位置及其性质递变的规律,非金属在元素周期表中的位置及其性质递变的规律
专题:元素周期律与元素周期表专题
分析:A.同周期自左而右原子半径减小,同主族自上而下原子半径逐渐增大;
B.非金属性越强,氢化物的稳定性越强;
C.非金属性越强,最高价氧化物对应水化物的酸性越强;
D.金属性越强,最高价氧化物对应水化物的碱性越强.
B.非金属性越强,氢化物的稳定性越强;
C.非金属性越强,最高价氧化物对应水化物的酸性越强;
D.金属性越强,最高价氧化物对应水化物的碱性越强.
解答:
解:A.同周期自左而右原子半径减小,同主族自上而下原子半径逐渐增大,故原子半径F<O<Al,故A正确;
B.非金属性P<N<O,非金属性越强,氢化物的稳定性越强,则稳定性PH3<NH3<H2O,故B错误;
C.非金属性越强,最高价氧化物对应水化物的酸性越强,则酸性:H2CO3<H3PO4<H2SO4,故C错误;
D.金属性Al<Li<Na,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:Al(OH)3<LiOH<NaOH,故D错误,
故选A.
B.非金属性P<N<O,非金属性越强,氢化物的稳定性越强,则稳定性PH3<NH3<H2O,故B错误;
C.非金属性越强,最高价氧化物对应水化物的酸性越强,则酸性:H2CO3<H3PO4<H2SO4,故C错误;
D.金属性Al<Li<Na,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:Al(OH)3<LiOH<NaOH,故D错误,
故选A.
点评:本题考查元素周期律的应用,注意掌握微粒半径比较规律、理解元素周期律,难度不大.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
下列化合物分子中既有离子键又有共价键的是( )
| A、BaCl2 |
| B、Na2O |
| C、(NH4)2SO4 |
| D、H2SO4 |
下列说法正确的是( )
| A、简单甘油酯是纯净物,混合甘油酯是混合物 |
| B、植物油是一种良好的有机溶剂,可以用来萃取溴水中的溴单质 |
| C、天然油脂都是混合物,没有恒定的熔点、沸点 |
| D、纯天然高分子是纯净物,合成高聚物一定是混合物 |
工业上用H2和N2直接合成氨:N2+3H2═2NH3,下列措施肯定能使合成氨反应速率加快的是( )
①升高温度 ②加入正催化剂 ③增大反应物浓度 ④增大压强.
①升高温度 ②加入正催化剂 ③增大反应物浓度 ④增大压强.
| A、只有①②③ | B、只有①②④ |
| C、只有①③④ | D、①②③④ |
在一定温度下,容器内某一反应中M、N的物质的量n随反应时间t变化的曲线如图所示,下列表述中正确的是( )


| A、反应的化学方程式为2M?N |
| B、t2时V正=V逆,达到平衡 |
| C、t3时V正>V逆 |
| D、t1时浓度C(N)=2C(M) |
如图,学生甲已将四种物质按照一定分类标准分类归入到椭圆形中,下列说法正确的是( )
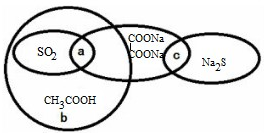

| A、SO2的水溶液能导电,所以SO2是电解质 |
| B、b可以代表含氧元素的离子化合物 |
| C、SO2、Na2C2O4均可作还原剂使酸性KMnO4溶液褪色 |
| D、CH3COOH与Na2S的反应称为酸碱中和反应 |
在Cu与稀HNO3的反应中,若有1mol HNO3被还原,则被氧化的Cu的物质的量为( )
A、
| ||
B、
| ||
| C、3mol | ||
D、
|