题目内容
17.下列化学用语正确的是( )| A. | 18O2-结构示意图: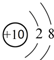 | |
| B. | 硝基苯的结构简式: | |
| C. | NaHSO4熔融时电离方程式:NaHSO4═Na++HSO4- | |
| D. | 模型 可表示甲烷分子或四氯化碳分子 可表示甲烷分子或四氯化碳分子 |
分析 A.根据元素符号左下角表示质子数,左上角表示质量数,阴离子的电子数=质子数+电荷数,根据核外电子数画出其离子结构示意图;
B.硝基苯中,应该是氮原子与苯环的碳原子相连;
C.熔化时NaHSO4的时候,只电离出钠离子与硫酸氢根离子;
D.甲烷分子或四氯化碳分子均为正四面体构型,但原子半径为:Cl>C>H.
解答 解:A.18O2-的质子数是8,质量数是18,阴离子的电子数=质子数+电荷数.所以其电子数为10,离子结构示意图为: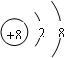 ,故A错误;
,故A错误;
B.硝基苯中,硝基的N原子与苯环的C原子相连,硝基苯正确的结构简式为: ,故B错误;
,故B错误;
C.熔化时NaHSO4的时候,只电离出钠离子与硫酸氢根离子,电离方程式为:NaHSO4═Na++HSO4-,故C正确;
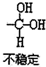
D.甲烷分子或四氯化碳分子均为正四面体构型,但原子半径为Cl>C>H,则比例模型 表示甲烷分子,而不能表示四氯化碳,四氯化碳的比例模型为:
表示甲烷分子,而不能表示四氯化碳,四氯化碳的比例模型为: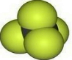 ,故D错误;
,故D错误;
故选C.
点评 本题考查了化学用语的判断,属于基础知识的考查,题目难度中等,培养了学生规范答题的能力.

练习册系列答案
相关题目
2.M是苯的同系物,其结构为 ,则M的结构式种类为( )
,则M的结构式种类为( )
 ,则M的结构式种类为( )
,则M的结构式种类为( )| A. | 16 | B. | 12 | C. | 10 | D. | 8 |
9.下列有关(NH4)Al(SO4)2溶液的叙述正确的是( )
| A. | 能大量存在:Na+、C6H5O-、Cl-、Br- | |
| B. | 同温下通入少量的氨气:NH4+的水解能力增强,Kw增大,有白色沉淀产生 | |
| C. | 加入Ba(OH)2溶液生成沉淀质量最多的离子方程式:NH4++Al3++2Ba2++5OH-+2SO42-=2BaSO4↓+AlO2-+NH3•H2O+2H2O | |
| D. | 其浓溶液可与NaHCO3溶液混合制成灭火器 |
3.化学与资源、环境、生活关系密切,下列说法正确的是( )
| A. | 二氧化硫有毒,严禁将其添加到任何食品和饮料中 | |
| B. | “氟化物防治龋齿”是应用了沉淀转化的原理,产生更能抵抗酸侵蚀的物质 | |
| C. | 使用增塑剂-邻苯二甲酸酯可使聚氯乙烯由弹性塑胶变为硬塑胶 | |
| D. | 面粉生产中禁止添加的过氧化钙(CaO2)中阴阳离子的个数比为1:2 |
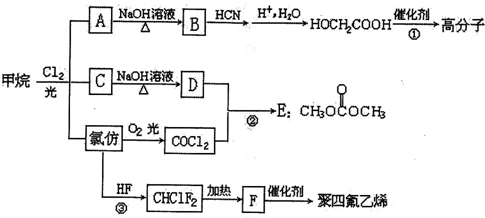

 $\stackrel{自动}{→}$
$\stackrel{自动}{→}$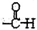
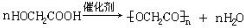 ②
②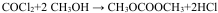

 $\stackrel{HCN}{→}$
$\stackrel{HCN}{→}$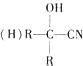 $→_{H+}^{H_{2}O}$
$→_{H+}^{H_{2}O}$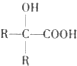
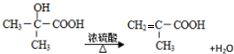
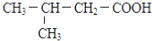 B.
B.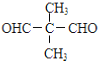 C.
C.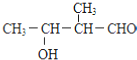 D.
D.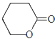
 .
. )可以生物降解,实现在自然界中的循环,是理想的绿色高分 子材料.请以乙醛为有机原料,设计聚乳酸的合成路线.(无机试剂任选,合成路线参照“已 知”中的书写形式)
)可以生物降解,实现在自然界中的循环,是理想的绿色高分 子材料.请以乙醛为有机原料,设计聚乳酸的合成路线.(无机试剂任选,合成路线参照“已 知”中的书写形式) .
.
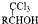
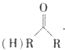
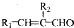 (R、R1、R2代表烃基或氢原子)
(R、R1、R2代表烃基或氢原子)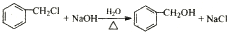 ;
;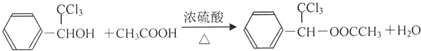 ;
;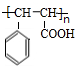 ;
; .
.