题目内容
5.已建立平衡的某可逆反应,当改变条件使化学平衡向逆反应方向移动时,下列叙述正确的是( )①生成物的体积分数一定减小 ②反应物的物质的量一定增加 ③生成物的物质的量浓度
一定减小 ④反应物的物质的量浓度一定增加 ⑤正反应速率一定小于逆反应速率.
| A. | ①②④⑤ | B. | ①②③⑤ | C. | ②③ | D. | ②⑤ |
分析 影响化学平衡移动的因素有温度、浓度和压强,据勒夏特列原理分析,平衡向减弱这种改变的方向移动,据此分析.
解答 解:化学平衡向逆反应方向移动时,
①若增大生成物浓度使平衡逆向移动,增大浓度的生成物的体积分数增大,故错误;
②平衡逆向移动,生成物物质的量减小,反应物的物质的量增多,故正确;
③若增大生成物浓度使平衡逆向移动,生成物的物质的量浓度可能增大,故错误;
④若减小反应物浓度使平衡逆向移动,反应物的物质的量浓度可能减小,故错误;
⑤平衡逆向移动,正反应速率一定小于逆反应速率,故正确;
故选D.
点评 本题考查化学平衡的影响因素,题目难度中等,注意影响化学平衡移动的因素,解答时注意从勒沙特列原理的角度分析.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.关于蛋白质的下列说法正确的是( )
| A. | 天然蛋白质中仅含C、H、O、N四种元素 | |
| B. | 重金属盐能使蛋白质变性,所以误食重金属盐会中毒 | |
| C. | 加热会使蛋白质变性,因此生吃鸡蛋比熟吃好 | |
| D. | 鸡蛋清加入食盐,会使蛋白质变性 |
16.下列有关化学用语表示正确的是( )
| A. | 过氧化钠的电子式: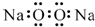 | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | 硫原子的结构示意图: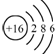 | D. | NH4Cl的电子式: |
13.下列实验方案设计中,可行的是( )
| A. | 碘和四氯化碳形成的溶液可以用蒸馏的方法来分离 | |
| B. | 用萃取的方法分离汽油和煤油 | |
| C. | 用溶解和过滤的方法分离硝酸钾和氯化钠固体混合物 | |
| D. | 将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2 |
20.向2.0L恒容密闭容器中充入1.0mol PCl5,在温度为T时发生如下反应PCl5(g)?PCl3(g)+Cl2(g)△H=+124kJ•mol-1.反应过程中测定的部分数据见如表:
回答下列问题:
(1)反应在前50s的平均速率v(PCl5)=0.0016mol/(L•s).
(2)要提高平衡时PCl3的体积分数,可采取的措施有CD.
A.温度不变,压缩容器体积增大压强 B.使用高效催化剂
C.温度和体积不变,减小PCl5的起始量 D.体积不变,提高反应温度
(3)温度为T时,该反应的化学平衡常数=0.025.
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a=0.1.
(5)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),该反应的化学方程式是PCl5+4H2O=H3PO4+5HCl.
| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
(1)反应在前50s的平均速率v(PCl5)=0.0016mol/(L•s).
(2)要提高平衡时PCl3的体积分数,可采取的措施有CD.
A.温度不变,压缩容器体积增大压强 B.使用高效催化剂
C.温度和体积不变,减小PCl5的起始量 D.体积不变,提高反应温度
(3)温度为T时,该反应的化学平衡常数=0.025.
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a=0.1.
(5)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),该反应的化学方程式是PCl5+4H2O=H3PO4+5HCl.
10.要求设计实验证明:某种盐的水解是吸热的.有四位同学分别设计如下方案,其中不正确的是( )
| A. | 甲同学:用加热的方法可除去KNO3溶液中混有的Fe3+,说明含Fe3+的盐水解是吸热的 | |
| B. | 乙同学:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的 | |
| C. | 丙同学:通过实验发现同浓度的热的纯碱溶液比冷的纯碱溶液去油污效果好,说明碳酸 钠水解是吸热的 | |
| D. | 丁同学:在醋酸钠溶液中滴入酚酞试液,加热(不考虑水蒸气)后若红色加深,说明醋酸钠水解是吸热的 |
17.金属铬(cr)的英文是Chromium,原意是颜色,因为它的化合物都有美丽的颜色.如表是几种常见铬的化合物或离子的水溶液的颜色:
含铬元素的化合物可以发生如图一系列变化:

(1)分别写出反应①、③、④的离子方程式:①Cr2O72-+3Zn+14H+=2Cr3++3Zn2++7H2O、③Cr(OH)3+OH-=CrO2-+2H2O、④2CrO2-+3H2O2+2OH-=2CrO42-+4H2O
(2)结合上述转化图及所学知识,请分析向NaCrO2溶液中逐滴加入过量稀硫酸的现象为绿色溶液中产生灰蓝色沉淀,后沉淀溶解,产生蓝紫色的溶液.
(3)在K2Cr2O7橙色溶液中逐滴加入NaOH溶液,溶液逐渐变为黄色,该反应的离子方程式为Cr2O72-+2OH-═2CrO42-+H2O.
(4)将KCl和CrCl3两种固体混合物共熔制得化合物X.将0.0035mol X中的Cr元素全部氧化成Cr2O72-,得到的Cr2O72-与过量的KI反应生成0.0105mol I2,反应的离子方程式为:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O.另取0.0035mol X溶于水中,当加入0.0385mol Ag NO3时,恰好沉淀完全.则表示X组成的化学式为K5Cr2Cl11.
| 离子或化合物 | Cr2O72- | Cr(OH)3 | Cr3+ | Cr°${\;}_{2}^{-}$ | CrO42- |
| 颜色 | 橙色 | 灰蓝色 | 蓝紫色 | 绿色 | 黄色 |

(1)分别写出反应①、③、④的离子方程式:①Cr2O72-+3Zn+14H+=2Cr3++3Zn2++7H2O、③Cr(OH)3+OH-=CrO2-+2H2O、④2CrO2-+3H2O2+2OH-=2CrO42-+4H2O
(2)结合上述转化图及所学知识,请分析向NaCrO2溶液中逐滴加入过量稀硫酸的现象为绿色溶液中产生灰蓝色沉淀,后沉淀溶解,产生蓝紫色的溶液.
(3)在K2Cr2O7橙色溶液中逐滴加入NaOH溶液,溶液逐渐变为黄色,该反应的离子方程式为Cr2O72-+2OH-═2CrO42-+H2O.
(4)将KCl和CrCl3两种固体混合物共熔制得化合物X.将0.0035mol X中的Cr元素全部氧化成Cr2O72-,得到的Cr2O72-与过量的KI反应生成0.0105mol I2,反应的离子方程式为:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O.另取0.0035mol X溶于水中,当加入0.0385mol Ag NO3时,恰好沉淀完全.则表示X组成的化学式为K5Cr2Cl11.
14.下列文字表述与反应方程式对应且正确的是( )
| A. | 苯制备硝基苯: | |
| B. | 用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 乙醇通入热的氧化铜中:CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O | |
| D. | 实验室用液溴和苯在催化剂作用下制溴苯: |
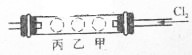 如图所示,有一个硬质玻璃管两端郡装有带导管的单孔塞,在试管中的右、中、左三个部位,分别放入浸有KI淀粉溶液的甲球、浸有NaI浓溶液的乙球和浸有KBr浓溶液的丙球.实验时,从右端缓慢通人C12,同时在乙处微微加热,并将热源从乙向丙处慢慢移动,观察到的现象是:
如图所示,有一个硬质玻璃管两端郡装有带导管的单孔塞,在试管中的右、中、左三个部位,分别放入浸有KI淀粉溶液的甲球、浸有NaI浓溶液的乙球和浸有KBr浓溶液的丙球.实验时,从右端缓慢通人C12,同时在乙处微微加热,并将热源从乙向丙处慢慢移动,观察到的现象是: