题目内容
【题目】有机物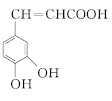 是一种重要的有机合成中间体,其合成路线如下:
是一种重要的有机合成中间体,其合成路线如下:
已知:①B的核磁共振氢谱有三个吸收峰;
②![]()
![]()
 ;
;
③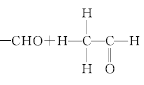
![]()
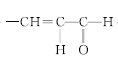 +H2O 。
+H2O 。
(1)B的名称为____________。
(2)反应⑤的反应类型为__________。G的结构简式为_______________。
(3)在合成路线中设计⑤和⑨两步反应的目的是________________。
(4)反应⑥的化学方程式为__________________。
(5)F与银氨溶液反应的化学方程式为________________。
(6)M为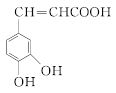 的同分异构体,满足下列条件的M的结构有________种。任写一种核磁共振氢谱有4组峰的M的结构简式_________________。
的同分异构体,满足下列条件的M的结构有________种。任写一种核磁共振氢谱有4组峰的M的结构简式_________________。
a.属于芳香族化合物 b.1 mol M与足量NaHCO3溶液反应能生成2 mol CO2
(7)参照上述合成路线,以乙醇为原料(其他无机试剂任选),设计制备正丁醇的合成路线_____________。
【答案】对溴甲苯或4-溴甲苯 取代反应 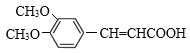 保护酚羟基 2
保护酚羟基 2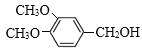 +O2
+O2![]() 2
2 +2H2O
+2H2O 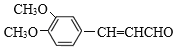 +2Ag(NH3)2OH
+2Ag(NH3)2OH![]()
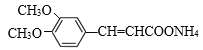 +2Ag↓+3NH3+H2O 10
+2Ag↓+3NH3+H2O 10 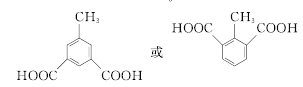 CH3CH2OH
CH3CH2OH![]() CH3CHO
CH3CHO![]() CH3CH=CHCHO
CH3CH=CHCHO![]() CH3CH2CH2CH2OH
CH3CH2CH2CH2OH
【解析】
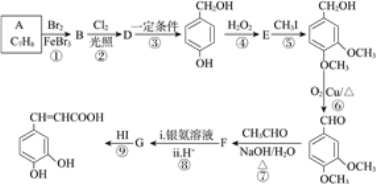
A的分子式是C7H8,根据物质反应过程中分子骨架不变,可知A是甲苯![]() ,A与Br2在FeBr3作用下发生苯环上的取代反应产生B:
,A与Br2在FeBr3作用下发生苯环上的取代反应产生B:![]() ,
,![]() 在在光照时与Cl2发生甲基上的取代反应产生D:
在在光照时与Cl2发生甲基上的取代反应产生D:![]() ,该物质在一定条件下反应产生
,该物质在一定条件下反应产生![]() ,
,![]() 被H2O2氧化产生E:
被H2O2氧化产生E: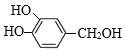 ,
, 与CH3I发生取代反应产生
与CH3I发生取代反应产生 ,该物质含有醇羟基,与O2在Cu催化下加热,发生氧化反应产生
,该物质含有醇羟基,与O2在Cu催化下加热,发生氧化反应产生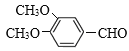 ,
, 与CH3CHO在NaOH水溶液中加热,反应产生F:
与CH3CHO在NaOH水溶液中加热,反应产生F: ,F含有醛基,与银氨溶液发生银镜反应,然后酸化可得G:
,F含有醛基,与银氨溶液发生银镜反应,然后酸化可得G: ,G与HI反应产生
,G与HI反应产生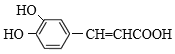 。
。
(7)乙醇催化氧化产生乙醛:CH3CHO,乙醛在NaOH水溶液中加热反应产生CH3CH=CH-CHO,CH3CH=CH-CHO与H2在催化剂存在时加热,发生加成反应产生丁醇CH3CH2CH2CH2OH。
根据上述分析可知,B为![]() 、D为
、D为![]() 、E为
、E为 、F为
、F为 、G为
、G为 。
。
(1)B的结构简式为![]() ,B的名称是对溴甲苯或4-溴甲苯。
,B的名称是对溴甲苯或4-溴甲苯。
(2)反应⑤是 与CH3I发生取代反应产生
与CH3I发生取代反应产生 和HI,该反应类型为取代反应;物质G的结构简式为
和HI,该反应类型为取代反应;物质G的结构简式为 。
。
(3)在合成路线中设计⑤使酚-OH变为-OCH3,在反应⑨中又使-OCH3转化为酚-OH,设计两步反应的目的是保护酚羟基在后续步骤中不被氧化。
(4)反应⑥是醇羟基被氧化为醛基,该反应的化学方程式为2 +O2
+O2![]() 2
2 +2H2O。
+2H2O。
(5)F与银氨溶液反应的化学方程式为 +2Ag(NH3)2OH
+2Ag(NH3)2OH![]()
 +2Ag↓+3NH3+H2O。
+2Ag↓+3NH3+H2O。
(6)满足条件的M的同分异构体有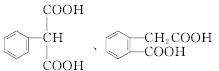 (邻、间、对位3种)、
(邻、间、对位3种)、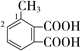 (甲基在1、2位置2种)、
(甲基在1、2位置2种)、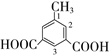 (甲基在1、2、3位置3种)、
(甲基在1、2、3位置3种)、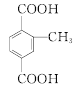 ,共10种;其中核磁共振氢谱有4组峰的结构简式为
,共10种;其中核磁共振氢谱有4组峰的结构简式为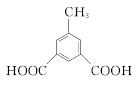 或
或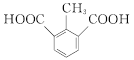 。
。
(7)乙醇催化氧化产生CH3CHO,乙醛在NaOH水溶液中加热反应产生CH3CH=CH-CHO,CH3CH=CH-CHO与H2在催化剂存在时加热,发生加成反应产生丁醇CH3CH2CH2CH2OH,所以由乙醇制取丁醇的合成路线为 CH3CH2OH![]() CH3CHO
CH3CHO![]() CH3CH=CHCHO
CH3CH=CHCHO![]() CH3CH2CH2CH2OH。
CH3CH2CH2CH2OH。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案【题目】下列实验中的现象,与氧化还原反应无关的是
A | B | C | D | |
实验 | 酒精溶液滴入高锰酸钾溶液中 | 石蕊溶液滴入氯水中 |
| 常温下,铝片插入浓硫酸中 |
现象 | 高锰酸钾溶液褪色 | 溶液变红,随后迅速褪色 | 沉淀由黄色逐渐变为黑色 | 无明显现象 |
A.AB.BC.CD.D
【题目】Ⅰ、由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引用了各界的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示:
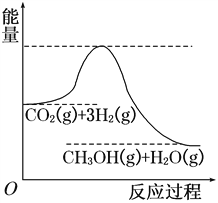
(1)上述反应平衡常数K的表达式为________________,温度降低,平衡常数K________(填“增大”、“不变”或“减小”)。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5 min末,用氢气浓度变化表示的平均反应速率v(H2)=________。
t/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
(3)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是________(填写序号字母)。
a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1 mol CO2和3 mol H2
d.选择高效催化剂
Ⅱ、(1)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,如图所示(T1、T2均大于300℃)
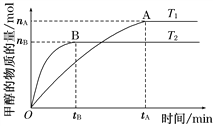
下列说法正确的是________(填序号);
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
(2)在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为_____________。