题目内容
下列各组微粒中,核外电子总数相等的是( )
| A、H2O 和Al3+ |
| B、CO和CO2 |
| C、Na+和Li+ |
| D、NO和CO |
考点:原子核外电子排布
专题:
分析:在原子中,核内质子数等于核外电子数,分子是由原子构成的,分子的电子总数就等于构成分子的各原子的电子数之和,阳离子的核外电子数等于核内质子数-电荷数.
解答:
解:A、氢原子有1个电子,氧原子有8个电子,H2O核外电子总数是10,Al3+核外电子总数是10,故A正确;
B、碳原子有6个电子,氧原子有8个电子,CO核外电子总数是14,CO2核外电子总数是22,故B错误;
C、Na+有10个电子,Li+有2个电子,故C错误;
D、氮原子有7个电子,CO核外电子总数是14,NO核外电子总数是15,故D错误;
故选A.
B、碳原子有6个电子,氧原子有8个电子,CO核外电子总数是14,CO2核外电子总数是22,故B错误;
C、Na+有10个电子,Li+有2个电子,故C错误;
D、氮原子有7个电子,CO核外电子总数是14,NO核外电子总数是15,故D错误;
故选A.
点评:本题考查了分子和阳离子中电子数的计算,对于常见的微粒,要能够正确计算微粒中的质子数和电子数.

练习册系列答案
相关题目
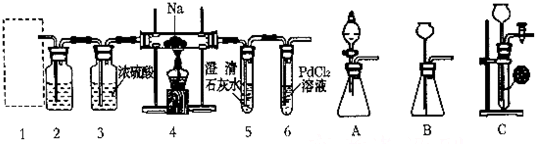
如图有关实验装置进行的相应实验,能达到实验目的是( )


| A、图1可证明乙醇发生消去反应生成了乙烯 |
| B、图2用于实验室制备乙酸乙酯 |
| C、图3用于配制银氨溶液 |
| D、图4用于实验室制硝基苯 |