题目内容
1.下表是元素周期表的一部分,用元素符号或化学式回答下列问题:| 周期 族 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
(2)写出有序号标出的元素中金属性最强的元素在元素周期表中的位置第三周期IA族.
(3)标况下,1mol的①在④中完全燃烧放出285.8kJ热量,写出该反应的热化学方程式2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol.
(4)写出从两种不同角度比较⑥与⑦两种元素金属性的方法根据金属与水或酸反应剧烈程度,比较最高价氧化物对应水化物的碱性强弱.
分析 由元素在周期表中的位置可知,①为H,②为C,③为N,④为O,⑤为F,⑥为Na,⑦为Mg,⑧为P,⑨为S,⑩为Cl.
(1)F元素没有最高价含氧酸,故最高价氧化物对应的水化物中酸性最强的是高氯酸,高氯酸与氢氧化钠发生中和反应;
(2)周期表中从左到右金属性减弱,同主族从上到下金属性增强;
(3)注明物质的聚集状态与反应热书写热化学方程式;
(4)可能根据金属与水或酸反应剧烈程度、难易程度,以及最高价氧化物对应水化物的碱性强弱等判断金属性强弱.
解答 解:由元素在周期表中的位置可知,①为H,②为C,③为N,④为O,⑤为F,⑥为Na,⑦为Mg,⑧为P,⑨为S,⑩为Cl.
(1)F元素没有最高价含氧酸,故最高价氧化物对应的水化物中酸性最强的是HClO4,高氯酸与氢氧化钠发生中和反应,反应离子方程式为:H++OH-=H2O,
故答案为:HClO4;H++OH-=H2O;
(2)周期表中从左到右金属性减弱,同主族从上到下金属性增强,故Na的金属性最强,处于周期表中第三周期IA族,
故答案为:第三周期IA族;
(3)标况下,1mol的H2在O2中完全燃烧放出285.8kJ热量,则2mol氢气燃烧放出的热量为285.8kJ×2=571.6kJ,该反应热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol,
故答案为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol;
全燃烧放出285.8kJ热
(4)比较Na与Mg两种元素金属性的方法:根据金属与水或酸反应剧烈程度,比较最高价氧化物对应水化物的碱性强弱,
故答案为:根据金属与水或酸反应剧烈程度,比较最高价氧化物对应水化物的碱性强弱.
点评 本题考查元素周期表与元素周期律的综合运用,比较基础,注意掌握金属性、非金属性强弱比较实验事实.

 ,下列对该化合物的叙述正确的是( )
,下列对该化合物的叙述正确的是( )| A. | 它属于芳香烃 | B. | 它属于醇类 | ||
| C. | 分子式为C13H17O2N2 | D. | 在一定条件下可以发生加成反应 |
| A. | 煤的干馏包括化学变化和物理变化 | |
| B. | 沼气(主要成分是CH4)是可再生能源 | |
| C. | 人类利用的能源都是通过化学反应获得的 | |
| D. | 石油是由1-50个碳原子的烷烃和环烷烃组成的混合物 |
| A. | CH2=CHCH(Br)CH2Br | B. | CH2=CH(Br)CHCH2Br | C. | CH2=CH2CH2CHBr2 | D. | CH Br2CH=CHCH3 |
| A. | 用“地沟油”中油脂生产航空生物煤油 | |
| B. | 用细菌浸取法以含硫化铜贫矿制取铜盐 | |
| C. | 用水代替化工合成反应中某些有机 | |
| D. | 将废铅蓄电池深埋处理,节约回收成本 |
| A. | 对燃煤进行脱硫 | |
| B. | 对含SO2、NO2等工业废气进行无害处理后,再排放到大气中 | |
| C. | 人工收集雷电作用所产生的氮的氧化物 | |
| D. | 飞机、汽车等交通工具采用清洁燃料,如天然气、甲醇等 |

下列有关依托孕烯的说法正确的是( )
| A. | 依托孕烯的分子式为C21H28O2 | |
| B. | 依托孕烯能与FeCl3溶液发生显色反应 | |
| C. | l mol依托孕烯最多能与6 mol氢气发生加成反应 | |
| D. | 依托孕烯能发生氧化、加成、消去、酯化等反应 |
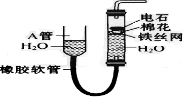 如图中的实验装置可用于制取乙炔. 请填空:
如图中的实验装置可用于制取乙炔. 请填空: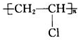 .
.