题目内容
 现有A、B、C、D、E五种短周期元素,已知:①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;②A、D同主族,A是所有元素中原子半径最小的元素;③通常状况下,A2、B2、C2三种单质均为常见无色气体;④B、D、E三者的最高价氧化物对应的水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素.请填写下列空白:
现有A、B、C、D、E五种短周期元素,已知:①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;②A、D同主族,A是所有元素中原子半径最小的元素;③通常状况下,A2、B2、C2三种单质均为常见无色气体;④B、D、E三者的最高价氧化物对应的水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素.请填写下列空白:(1)写出化学式:B2
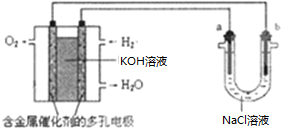
(2)将A2、C2按图所示通入某燃料电池中,其中,b电极为
(3)E单质与乙的溶液反应生成物质丁和A2气体,写出反应的离子方程式
(4)用石墨作电极,电解上述丁的水溶液500mL,两极产生气泡.持续电解一段时间后停止通电,在整个过程中阳极附近的溶液还可观察到的现象是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E五种短周期元素,原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;A、D同主族,A是所有元素中原子半径最小的元素,则A为氢元素,则D为钠元素,B、D、E三者的最高价氧化物对应的水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素,则C为氧元素,E为铝元素,通常状况下,A2、B2、C2三种单质均为常见无色气体,则B为氮元素,甲为硝酸,乙为氢氧化钠,丙为氢氧化铝,据此答题;
解答:
解:A、B、C、D、E五种短周期元素,原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;A、D同主族,A是所有元素中原子半径最小的元素,则A为氢元素,则D为钠元素,B、D、E三者的最高价氧化物对应的水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素,则C为氧元素,E为铝元素,通常状况下,A2、B2、C2三种单质均为常见无色气体,则B为氮元素,甲为硝酸,乙为氢氧化钠,丙为氢氧化铝,
(1)根据上面的分析可知,B2 为N2 ,丙为Al(OH)3,
故答案为:N2 ;Al(OH)3;
(2)氢氧燃料电池中,氧气作氧化剂,在电池的正极反应,所以其b电极为正极,电极反应式为O2 +4e-+2H2O═4OH-,
故答案为:正;O2 +4e-+2H2O═4OH-;
(3)铝和氢氧化钠反应的离子方程式为2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑,
故答案为:2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑;
(4)用石墨作电极,电解偏铝酸钠溶液,两极产生氢气和氧气,在整个过程中阳极附近的氢氧根离子放电,会产生氢离子,遇偏铝根离子产生氢氧化铝沉淀,所以可以观察到的现象是白色沉淀产生,由于此时阴极上是氢离子放电,溶液中会产生氢氧根离子,又可以将氢氧化铝溶解,有关反应离子方程式为[Al(OH)4]-+H+═Al(OH)3↓+H2O; Al(OH)3+3H+═Al3++3H2O,当电路中通过amol电子时,在阴极上会产生氢气0.5mol,阳极上产生氧气0.25mol,所以两极共产生气体0.75mol,即16.8 L,
故答案为:有白色沉淀产生后又逐渐溶解;Al(OH)4]-+H+═Al(OH)3↓+H2O; Al(OH)3+3H+═Al3++3H2O;16.8;
(1)根据上面的分析可知,B2 为N2 ,丙为Al(OH)3,
故答案为:N2 ;Al(OH)3;
(2)氢氧燃料电池中,氧气作氧化剂,在电池的正极反应,所以其b电极为正极,电极反应式为O2 +4e-+2H2O═4OH-,
故答案为:正;O2 +4e-+2H2O═4OH-;
(3)铝和氢氧化钠反应的离子方程式为2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑,
故答案为:2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑;
(4)用石墨作电极,电解偏铝酸钠溶液,两极产生氢气和氧气,在整个过程中阳极附近的氢氧根离子放电,会产生氢离子,遇偏铝根离子产生氢氧化铝沉淀,所以可以观察到的现象是白色沉淀产生,由于此时阴极上是氢离子放电,溶液中会产生氢氧根离子,又可以将氢氧化铝溶解,有关反应离子方程式为[Al(OH)4]-+H+═Al(OH)3↓+H2O; Al(OH)3+3H+═Al3++3H2O,当电路中通过amol电子时,在阴极上会产生氢气0.5mol,阳极上产生氧气0.25mol,所以两极共产生气体0.75mol,即16.8 L,
故答案为:有白色沉淀产生后又逐渐溶解;Al(OH)4]-+H+═Al(OH)3↓+H2O; Al(OH)3+3H+═Al3++3H2O;16.8;
点评:本题主要考查了原电池和电解池的相关知识,有一定的综合性,中等难度,解题的关键在于元素和物质的推断.

练习册系列答案
相关题目
某一元醛发生银镜反应,可得21.6g银,等量的该醛完全燃烧时,可生成5.4g水,则该醛可能是( )
| A、乙醛 |
| B、丙醛 |
| C、丁醛 |
| D、丁烯醛(CH2=CH-CH2-CHO) |
1molCl2和1molCO2相比较,下列叙述中正确的是( )
| A、分子数相等 | B、原子数相等 |
| C、体积相等 | D、质量相等 |
元素X形成的气态X2的分子共有三种,其相对分子质量依次为158、160、162,此三种分子的物质的量之比为9:6:1,据此,下列说法中正确的是( )
| A、X有三种同位素 |
| B、其中一种同位素的质量为80 |
| C、X2的平均相对分子质量为159 |
| D、质量数为79的同位素的原子百分数为50% |
体积和pH值均相等的A(一元强酸)和B(一元弱酸)两种酸溶液,已知B的电离度为1.3%,则两种酸中和碱的能力相比( )
| A、B是A的1.3倍 |
| B、B是A的76.9倍 |
| C、B是A的98.7倍 |
| D、无法判断 |
化学与生活、社会密切相关.下列说法不正确的是( )
| A、石油裂解、煤的气化、海水的提镁都包含化学变化 |
| B、高温条件下杀死H7N9型禽流感病毒,属于蛋白质的变性 |
| C、纯碱可用于生产普通玻璃,也可用纯碱除去物品表面的油污 |
| D、气候环境报告中“PM2.5”就是雾霾,雾霾仅影响能见度,对人体健康没有影响 |
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性强弱顺序为Cl-<Fe2+<H2O2<I-<SO2,则下列反应不能发生的是( )
| A、H2O2+H2SO4=SO2↑+O2↑+2H2O |
| B、2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
| C、SO2+I2+2H2O=H2SO4+2HI |
| D、Cl2+SO2+2H2O=H2SO4+2HCl |