题目内容
8.用氯化铁溶液蚀刻印刷铜电路板的离子反应方程式2Fe3++Cu=2Fe2++Cu2+.分析 氯化铁溶液蚀刻印刷铜电路板反应生成氯化亚铁和氯化铜,据此写出反应的离子方程式.
解答 解:氯化铁溶液蚀刻印刷铜电路板反应生成氯化亚铁和氯化铜,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,
故答案为:2Fe3++Cu=2Fe2++Cu2+.
点评 本题考查了离子方程式的书写,题目难度不大,明确发生反应原理为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.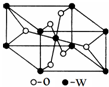 海底热液研究处于当今科研的前沿.海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物.
海底热液研究处于当今科研的前沿.海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物.
(1)Fe2+的核外电子排布式是[Ar]3d6或1s22s22p63s23p63d6.
(2)分析下表,铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,主要原因是气态Cu失去一个电子变成结构为[Ar]3d10的Cu+,能量较低,所以Cu的第二电离能相对较大(或气态Zn失去一个电子变成结构为[Ar]3d104s1的Zn+,易再失去一个电子,所以Zn的第二电离能相对较小).
(3)下列说法正确的是BCD.
A.电负性:N>O>S>C
B.CO2与COS(硫化羰)互为等电子体
C.NH3分子中氮原子采用sp3杂化
D.CO、H2S、HCN都是极性分子
(4)CH4与元素X的一种含氢粒子互为等电子体,元素X的这种含氢粒子的化学式是NH4+.
(5)W的原子序数为22,它的一种氧化物晶胞结构如图所示,该氧化物的化学式为TiO2.
(6)在浓的WCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为WCl3•6H2O的绿色晶体,该晶体中两种配位体的物质的量之比为1:5,则该配合物的化学式为[TiCl(H2O)5]Cl2•H2O.
 海底热液研究处于当今科研的前沿.海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物.
海底热液研究处于当今科研的前沿.海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物.(1)Fe2+的核外电子排布式是[Ar]3d6或1s22s22p63s23p63d6.
(2)分析下表,铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,主要原因是气态Cu失去一个电子变成结构为[Ar]3d10的Cu+,能量较低,所以Cu的第二电离能相对较大(或气态Zn失去一个电子变成结构为[Ar]3d104s1的Zn+,易再失去一个电子,所以Zn的第二电离能相对较小).
| 电离能/kJ•mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
A.电负性:N>O>S>C
B.CO2与COS(硫化羰)互为等电子体
C.NH3分子中氮原子采用sp3杂化
D.CO、H2S、HCN都是极性分子
(4)CH4与元素X的一种含氢粒子互为等电子体,元素X的这种含氢粒子的化学式是NH4+.
(5)W的原子序数为22,它的一种氧化物晶胞结构如图所示,该氧化物的化学式为TiO2.
(6)在浓的WCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为WCl3•6H2O的绿色晶体,该晶体中两种配位体的物质的量之比为1:5,则该配合物的化学式为[TiCl(H2O)5]Cl2•H2O.
3.两种微粒的质子数、电子数均相等,则它们可能是:①同位素;②不同的分子;③不同的离子;④同一元素的不同离子.则上述说法正确的是( )
| A. | ①②③④ | B. | ①③④ | C. | ③④ | D. | ①②③ |
13.下列说法正确的是( )
| A. | 32g O2占有的体积约为22.4L | |
| B. | 22.4LN2含有NA个氮气分子 | |
| C. | 在标准状况下,22.4L水的质量约为18g | |
| D. | 11g二氧化碳与标准状况下5.6L HCl含有相同的分子数 |
20.下列有机反应中,与其它三个反应类型不同的是( )
| A. |  | |
| B. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | |
| C. | 2C2H5OH→C2H5-O-C2H5+H2O | |
| D. |  |
17.对于淀粉和纤维素的叙述,正确的是( )
| A. | 因为都是多糖,所以都具有甜味 | |
| B. | 因为具有相同的分子式(C6H10O5)n,所以互为同分异构体 | |
| C. | 两者都能水解生成葡萄糖 | |
| D. | 淀粉不是天然高分子化合物 |
18.下列离子化合物中,阴、阳离子个数比与其他化合物不同的是( )
| A. | Na2O2 | B. | Na2O | C. | Na2S | D. | NH4HSO4 |
