题目内容
7.25℃,101kPa时,使1.0g钠与足量氯气反应,生成氯化钠晶体并放出17.87kJ的热量,生成1mo NaCl的反应热为( )| A. | 17.87kJ | B. | -17.87kJ/mol | C. | 411 kJ/mol | D. | -411 kJ/mol |
分析 钠和氯气反应生成氯化钠的化学方程式为:2Na+Cl2=2NaCl,根据反应热与化学计量数成正比计算生成1mo NaCl的反应热,当反应是放热反应△H<0.
解答 解:1.0g钠的物质的量为n=$\frac{m}{M}$=$\frac{1.0g}{23g/mol}$=$\frac{1}{23}$mol,生成氯化钠晶体并放出17.87kJ的热量,钠和氯气反应:2Na+Cl2=2NaCl,1mol钠反应生成1mol氯化钠,反应热与化学计量数成正比,所以生成1mo NaCl的放热为17.87kJ×23≈-411 kJ,当反应是放热反应△H<0,所以反应热为-411KJ/mol,
故选D.
点评 本题考查了反应热的计算,理解热化学方程式的概念和掌握能量变化与化学计量数间的关系是解答关键,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.关于实验室制乙炔的说法不正确的是( )
| A. | 因反应太剧烈,可用分液漏斗控制滴水速度来控制反应速度 | |
| B. | 为了得到比较平缓的乙炔气流,可用饱和食盐水代替水 | |
| C. | 乙炔气体中混有PH3和H2S等杂质,可用硫酸铜溶液将其除去 | |
| D. | 为控制反应的速率,可用碳化钙粉末和饱和食盐水反应 |
2.下列对有关化学反应过程或实验现象的解释正确的是( )
| A. | 工业上用铝制容器盛装浓硫酸,说明常温下铝和浓硫酸不反应 | |
| B. | 在高温条件下,C能置换出SiO2中的Si,说明C的氧化性强于Si | |
| C. | 在空气中加热铝箔,发现内部的铝熔化但不滴落,说明铝不易与氧气反应 | |
| D. | 向淀粉碘化钾的溶液中加入氯水,溶液变为蓝色,说明Cl2的氧化性强于I2 |
12.下列说法不正确的是( )
①做一次中和热的测定,至少需要使用两次温度计.
②化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体.
③铝热反应属于放热反应.
④同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同.
①做一次中和热的测定,至少需要使用两次温度计.
②化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体.
③铝热反应属于放热反应.
④同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同.
| A. | ①④ | B. | ②④ | C. | ②③ | D. | ③④ |
19.下表是元素周期表的一部分,针对a~K十一种元素回答下列问题(请用具体化学式回答,否则不给分)
(1)这些元素中非金属性最强的单质是F2,最高价氧化物对应水化物酸性最强的是HClO4,最高价氧化物对应水化物碱性最强的是NaOH.
(2)表中K的氢化物的化学式为HCl,它的还原性比j的氢化物还原性弱(填“强”或“弱”),它水溶液的酸性比j的氢化物水溶液的酸性强(填“强”或“弱”).
(3)e单质为N2,其结构式为N≡N.
(4)用电子式表示h与k构成化合物的形成过程
(5)写出i的氧化物与强碱溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O
(6)H2和e的单质化合的反应是可逆反应,且该反应正方向放热.将等物质的量的H2、e的单质充入一恒容密闭容器中,在适当条件下反应.下列说法正确的是ACD(填写选项).
A.升高温度,不论正反应方向还是逆反应方向速率都加快
B.向上述容器中充入适量Ar气可加快反应速率
C.反应过程中,e的单质的体积分数始终为50%
D.反应器内压强不随时间变化而变化,说明反应到达平衡.
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | a | c | d | e | f | g | |
| 3 | b | h | i | j | k |
(2)表中K的氢化物的化学式为HCl,它的还原性比j的氢化物还原性弱(填“强”或“弱”),它水溶液的酸性比j的氢化物水溶液的酸性强(填“强”或“弱”).
(3)e单质为N2,其结构式为N≡N.
(4)用电子式表示h与k构成化合物的形成过程

(5)写出i的氧化物与强碱溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O
(6)H2和e的单质化合的反应是可逆反应,且该反应正方向放热.将等物质的量的H2、e的单质充入一恒容密闭容器中,在适当条件下反应.下列说法正确的是ACD(填写选项).
A.升高温度,不论正反应方向还是逆反应方向速率都加快
B.向上述容器中充入适量Ar气可加快反应速率
C.反应过程中,e的单质的体积分数始终为50%
D.反应器内压强不随时间变化而变化,说明反应到达平衡.
 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O,取代反应.
+3H2O,取代反应. ,加聚反应(或聚合反应).
,加聚反应(或聚合反应).
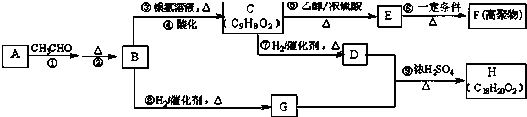
 .
. +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$ +H2O
+H2O
 +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$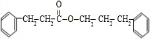 +H2O.
+H2O. .
.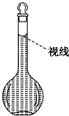 实验室需要配置0.50mol/L NaCl溶液500mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配置0.50mol/L NaCl溶液500mL.按下列操作步骤填上适当的文字,以使整个操作完整.