题目内容
锂电池广泛用于手机、数码相机及便携式电脑中.锂电池的负极通常由金属锂构成,正极由二氯亚砜和碳材料构成.此种锂电池在放电时有气体产生.

(1)写出锂电池放电时的负极反应、正极反应及总反应.
(2)从下面所给电对中选择合适的电对,利用其标准电极电势计算电池反应的标准电动势.
E°(
)=-3.045V;E°(
)=1.360V;E°(
)=-0.310V;E°(
)=-0.520V
(3)常温下,若电池反应系数为整数时的平衡常数为1.0×103 Pa,求所产生气体的平衡分压.
(4)该反应的熵是增加还是减少?反应是否自发进行?

(1)写出锂电池放电时的负极反应、正极反应及总反应.
(2)从下面所给电对中选择合适的电对,利用其标准电极电势计算电池反应的标准电动势.
E°(
| Li |
| Li+ |
| Cl2 |
| Cl- |
| S |
| S2- |
| S4+ |
| S |
(3)常温下,若电池反应系数为整数时的平衡常数为1.0×103 Pa,求所产生气体的平衡分压.
(4)该反应的熵是增加还是减少?反应是否自发进行?
考点:原电池和电解池的工作原理,焓变和熵变
专题:电化学专题
分析:(1)原电池的负极上发生失电子的氧化反应,正极上发生得电子的还原反应,正极和负极反应的和即为总反应,据此回答判断;
(2)根据标准电动势的计算方法Eθ=Eθ(正)-Eθ(负)来回答;
(3)根据平衡常数和气体产物的平衡浓度系数次幂之积和气体反应物的平衡浓度系数次幂之积之比来回答;
(4)根据电池反应中物质的状态结合反应的自发性进行判断.
(2)根据标准电动势的计算方法Eθ=Eθ(正)-Eθ(负)来回答;
(3)根据平衡常数和气体产物的平衡浓度系数次幂之积和气体反应物的平衡浓度系数次幂之积之比来回答;
(4)根据电池反应中物质的状态结合反应的自发性进行判断.
解答:
解:(1)锂电池广泛用于手机、数码相机及便携式电脑中,锂电池的负极通常由金属锂构成,电极反应是:4Li-4e-=4Li+,正极由二氯亚砜和碳材料构成,电极反应是:SOCl2-4e-=S+SO2+4Cl-,正极和负极反应的和即为总反应:4Li+SOCl2=S+SO2+4LiCl,
答:锂电池放电时的负反应、正极反应及总反应分别为:4Li-4e-=4Li+;SOCl2-4e-=S+SO2+4Cl-;4Li+SOCl2=S+SO2+4LiCl;
(2)根据电极反应中,元素的化合价变化,借助E°(
)=-3.045V;E°(
)=-0.520V,则电池反应的标准电动势:Eθ=Eθ(正)-Eθ(负)=-3.045V-(-0.520V)=2.525V,答:池反应的标准电动势是2.525V;
(3)根据电池反应中只有二氧化硫是气体,所以所产生气体的平衡分压Kp=P(二氧化硫)=1.0×103 Pa,答:所产生气体的平衡分压是1.0×103 Pa;
(4)该反应产物气体的系数和大于反应物,所以熵变是大于零的,电池的设计条件是自发的氧化还原反应,所以反应能自发进行,
答:该反应的熵是增加的,反应自发进行.
答:锂电池放电时的负反应、正极反应及总反应分别为:4Li-4e-=4Li+;SOCl2-4e-=S+SO2+4Cl-;4Li+SOCl2=S+SO2+4LiCl;
(2)根据电极反应中,元素的化合价变化,借助E°(
| Li |
| Li+ |
| S4+ |
| S |
(3)根据电池反应中只有二氧化硫是气体,所以所产生气体的平衡分压Kp=P(二氧化硫)=1.0×103 Pa,答:所产生气体的平衡分压是1.0×103 Pa;
(4)该反应产物气体的系数和大于反应物,所以熵变是大于零的,电池的设计条件是自发的氧化还原反应,所以反应能自发进行,
答:该反应的熵是增加的,反应自发进行.
点评:本题是一道和大学知识接轨的电化学知识的考查题,考查学生分析和解决问题的能力,在省化学奥赛题中出现,难度较大.

练习册系列答案
相关题目
有两种金属组成的混合物粉末10g与足量的稀盐酸反应,生成11.2L(标况)H2,则该混合物的组成可能是( )
| A、Fe、Zn |
| B、Fe、Cu |
| C、Cu、Mg |
| D、Al、Fe |
下列叙述不正确的是( )
| A、在基态多电子的原子中,最易失去的电子能量最高电离能也最小 |
| B、锗的第一电离能高于碳而电负性低于碳 |
| C、PH3分子呈三角锥形,沸点比NH3低 |
| D、SiF4和SO32-的中心原子均为sp3杂化 |
在t℃时,将agNH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρg?cm-1,质量分数为ω,其中含NH4+的物质的量为b moL.下列叙述中正确的是( )
A、溶质的质量分数为ω=
| ||
B、溶质的物质的量浓度c=
| ||
C、溶液中c (OH-)=
| ||
| D、上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω |
下列实验操作中,不合理的是( )
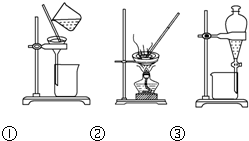

| A、洗涤沉淀时(如图①),向漏斗中加适量水,搅拌并滤干 | ||
| B、用CCl4提取碘水中的碘,选③ | ||
C、蒸馏时蒸馏烧瓶中液体的体积不能超过容积的
| ||
| D、粗盐提纯,选①和② |
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的是( )
A、 制取氯气 |
B、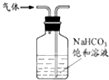 除去氯气中的少量氯化氢 |
C、 分离二氧化锰和氯化锰溶液 |
D、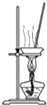 蒸干氯化锰溶液制MnCl2?4H2O |
下列对有关实验的描述不正确的是( )
| A、在浓氨水中加入生石灰可以制取少量的NH3 | ||||
B、用惰性电极电解熔融NaCl:2Cl-+2H2O
| ||||
| C、氯水和活性炭使红墨水褪色,能用同一原理解释 | ||||
| D、浓硫酸和浓盐酸长期暴露在空气中浓度都会降低 |
