题目内容
19.氢镍电池放电时的总反应为MH+NiOOH═M+Ni(OH)2.以氢镍电池为电源,能将废水中的CN-转化为CO32-和N2,该装置如图所示.下列说法不正确的是( )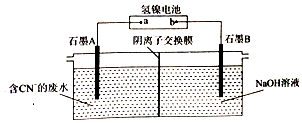
| A. | 电极a为正极 | |
| B. | 负极反应式为MH+OH--e-═H2O+MC | |
| C. | 每消耗1molC N-,理论上导线中通过3mo1e- | |
| D. | 阴极区溶液的PH增大 |
分析 镍氢电池根据总反应:MH+NiOOH=M+Ni(OH)2 ,放电时,正极:NiOOH+H2O+e-=Ni(OH)2+OH-,负极:MH+OH--e-=M+H2O;电解时,CN-转化为CO32-和N2,C、N失电子,在阳极反应,即A为阳极,则a为正极,B为阴极,阴极上氢离子得电子生成氢气,据此分析.
解答 解:A.电解时,CN-转化为CO32-和N2,C、N失电子,在阳极反应,即A为阳极,则a为正极,故A正确;
B.负极的电极方程式为:MH+OH--e-=M+H2O,故B正确;
C.C的化合价从+2升高到+4,N的化合价从-3升高到0,则每消耗1molC N-,理论上导线中通过5mo1e-,故C错误;
D.阴极上水电离的氢离子得电子生成氢气,所以溶液中氢氧根离子的浓度增大,则阴极区溶液的PH增大,故D正确.
故选C.
点评 本题考查原电池和电解池原理、电极反应式的书写,明确电极上得失电子及反应物质是解本题关键,电极反应式的书写是学习难点,注意结合化合价的变化分析,题目难度中等,侧重于考查学生的分析能力和应用能力.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案
相关题目
9. 磷酸铁锂(LiFePO4)电池是一种高效、环保的新型电池,装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐,电池工作时的总反应为:LiFePO4+6C $?_{放电}^{充电}$Li1-xFePO4+LixC6,则下列说法错误的是( )
磷酸铁锂(LiFePO4)电池是一种高效、环保的新型电池,装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐,电池工作时的总反应为:LiFePO4+6C $?_{放电}^{充电}$Li1-xFePO4+LixC6,则下列说法错误的是( )
 磷酸铁锂(LiFePO4)电池是一种高效、环保的新型电池,装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐,电池工作时的总反应为:LiFePO4+6C $?_{放电}^{充电}$Li1-xFePO4+LixC6,则下列说法错误的是( )
磷酸铁锂(LiFePO4)电池是一种高效、环保的新型电池,装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐,电池工作时的总反应为:LiFePO4+6C $?_{放电}^{充电}$Li1-xFePO4+LixC6,则下列说法错误的是( )| A. | 装置中的聚合物隔膜应为阳离子交换膜 | |
| B. | 充电时,Li+迁移方向为由右向左 | |
| C. | 充电时,LiFePO4中的铁元素被氧化 | |
| D. | 放电时,正极的电极反应式为:Li1-xFePO4+xLi++xe-═LiFePO4 |
10.以炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氧化锌和金属锌.
Ⅰ.制取氧化锌主要工艺如图1:
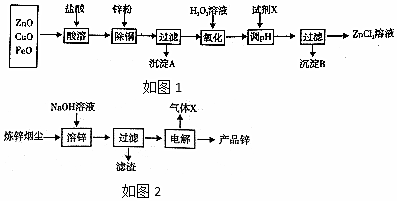
表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为l.0mol/L计算).
(1)为了加快反应,“酸溶”需要适当加热,但温度不宜太高,原因是减少盐酸挥发.
(2)加入H2O2溶液发生反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)流程图中,为了降低溶液的酸度,调节pH范围为3.2≤PH<5.2;若试剂X为Zn2(OH)2CO3,加入X除杂质的离子方程式为3Zn2(OH)2CO3+4Fe3++3H2O=4Fe(OH)3↓+6Zn2++3CO2↑.
(4)已知,室温下,Ksp[Fe(OH)3]=4.0×10-38,当pH=3时,溶液中c(Fe3+)为4.0×10-5.从ZnCl2溶液中提取无水ZnCl2的方法是在氯化氢气体,蒸干氯化锌溶液并加热至失去结晶水.
Ⅱ.制取金属锌采用碱溶解ZnO(s)+2NaOH (aq)+H2O═Na2[Zn(OH)4](aq),然后电解浸取液.
(5)如图2,炼锌烟尘采用碱溶,而不采用酸溶后电解,主要原因是氧化铜、氧化亚铁不溶于碱溶液中.
(6)以石墨作电极电解时,阳极产生的气体为O2;阴极的电极反应为[Zn(OH)4]2-+2e-=Zn+4OH-.
Ⅰ.制取氧化锌主要工艺如图1:

表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为l.0mol/L计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.2 | 6.4 |
| Fe2+ | 5.8 | 8.8 |
(2)加入H2O2溶液发生反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)流程图中,为了降低溶液的酸度,调节pH范围为3.2≤PH<5.2;若试剂X为Zn2(OH)2CO3,加入X除杂质的离子方程式为3Zn2(OH)2CO3+4Fe3++3H2O=4Fe(OH)3↓+6Zn2++3CO2↑.
(4)已知,室温下,Ksp[Fe(OH)3]=4.0×10-38,当pH=3时,溶液中c(Fe3+)为4.0×10-5.从ZnCl2溶液中提取无水ZnCl2的方法是在氯化氢气体,蒸干氯化锌溶液并加热至失去结晶水.
Ⅱ.制取金属锌采用碱溶解ZnO(s)+2NaOH (aq)+H2O═Na2[Zn(OH)4](aq),然后电解浸取液.
(5)如图2,炼锌烟尘采用碱溶,而不采用酸溶后电解,主要原因是氧化铜、氧化亚铁不溶于碱溶液中.
(6)以石墨作电极电解时,阳极产生的气体为O2;阴极的电极反应为[Zn(OH)4]2-+2e-=Zn+4OH-.
7.下列说法正确的是( )
| A. | 葡萄糖、蔗糖均可发生银镜反应 | |
| B. | 硫酸铵和乙酸铅均能使蛋白质发生变性 | |
| C. | 乙炔和乙醛均可作为合成聚合物的单体 | |
| D. | 淀粉和油脂都是能够发生水解反应的高分子化合物 |
14.化学与科学、技术、社会、环境密切相关.下列说法不正确的是( )
| A. | 为加快漂白精的漂白速率,使用时可滴加几滴醋酸 | |
| B. | 在食品袋中放人盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| C. | 用含橙色酸性重铬酸钾的仪器检验酒驾,利用了乙醇的挥发性和还原性 | |
| D. | 光太阳能电池先将光能转化为化学能,然后再将化学能转化为电能 |
4.某化合物的化学式为NH5,其电子式为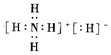 下列有关说法正确的是( )
下列有关说法正确的是( )
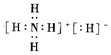 下列有关说法正确的是( )
下列有关说法正确的是( )| A. | 该化合物中氢元素的化合价均为+1价 | |
| B. | 该化合物中只有N原子最外层达到稀有气体的稳定结构 | |
| C. | 该化合物中含有$\stackrel{-1}{H}$与$\stackrel{+1}{H}$,二者互为同位素 | |
| D. | 该化合物中既含有共价键,又含有离子键 |
11.下列关于有机化合物的说法正确的是( )
| A. | 石油裂解和蛋白质水解都是由高分子化合物生成小分子物质的过程 | |
| B. | 乙烯分别使溴水和酸性KMnO4溶液褪色,反应原理相同 | |
| C. | C6H14有5种同分异构体 | |
| D. | CH4和Cl2按体积比1:3混合可制得纯净的CHCl3 |
8. 常温下,将除去表面氧化膜的A1、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示.反应过程中有红棕色气体产生.下列说法错误的是( )
常温下,将除去表面氧化膜的A1、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示.反应过程中有红棕色气体产生.下列说法错误的是( )
 常温下,将除去表面氧化膜的A1、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示.反应过程中有红棕色气体产生.下列说法错误的是( )
常温下,将除去表面氧化膜的A1、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示.反应过程中有红棕色气体产生.下列说法错误的是( )| A. | t1时刻前,A1片的电极反应为:2A1-6e-+3H2O═A12O3+6H+ | |
| B. | t1时,因A1在浓硝酸中钝化,氧化膜阻碍了A1继续反应 | |
| C. | t1之后,负极Cu失电子,电流方向发生改变 | |
| D. | 烧杯中发生的离子反应为:2NO2+2OH-═2NO3-+H2O |
8.下列对一些客观事实和理论解释正确的是( )
| 选项 | 事实 | 理论解释 |
| A | Na 与水反应失去 1 个电子,Mg 与水反应失去 2 个电子 | Na 的金属性比 Mg 强 |
| B | H2S 的还原性比 HCl | S 的非金属性比 Cl |
| C | K3C60在熔融状态下能够导电 | K3C60中含有离子 |
| D | Si 是半导体材料,同主族的 Ge 也 是半导体材料 | ⅣA 元素形成的单质都是半导体材料 |
| A. | A | B. | B | C. | C | D. | D |