题目内容
10. 某化学兴趣设计实验制取乙酸乙酯.现用右图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2ml 98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题:
某化学兴趣设计实验制取乙酸乙酯.现用右图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2ml 98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题:已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH.
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
(2)与书中采用的实验装置的不同之处是:这位同学采用了球形干燥管代替了长导管,并将干燥管的末端插入了饱和碳酸钠溶液中,在此处球形干燥管的作用除了使乙酸乙酯充分冷凝外还有防倒吸;加热一段时间后,可观察到烧杯D中液面上(填“上”或“下”)有无色油状液体生成,若分离该液体混合物,需要用到的玻璃仪器是分液漏斗,这种方法叫做分液.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇(或CaCl2•6C2H5OH);再加入无水硫酸钠,然后进行蒸馏,收集产品乙酸乙酯时,温度应控制在77.1℃左右.
(4)乙酸可使紫色石蕊试液变红,说明乙酸具有酸性,写出乙酸与碳酸钠溶液反应的离子方程式2CH3COOH+CO32-=2CH3COO?+H2O+CO2↑.
分析 (1)反应物乙酸含羧基,乙醇含羟基,羧酸与醇发生的酯化反应中,羧酸中的羧基提供-OH,醇中的-OH提供-H,相互结合生成水;
(2)球形干燥管的管口伸入液面下可能发生倒吸,同时起冷凝作用;烧杯D中是饱和碳酸钠溶液,乙酸乙酯密度小于水且难溶于水,在溶液上层,分离方法为分液;
(3)用氯化钙除去少量乙醇,用无水硫酸钠除去少量的水,无水硫酸钠吸水形成硫酸钠结晶水合物;根据乙酸乙酯的沸点判断温度;
(4)乙酸溶液中存在电离平衡电离出氢离子溶液显酸性,乙酸酸性大于碳酸.
解答 解:(1)该实验有机反应物乙酸和乙醇中含有的官能团有羟基、羧基,若用同位素18O示踪法确定反应产物水分子中氧原子的提供者(设18O在CH3CH2OH中),写出能表示18O位置的化学方程式 CH3COOH+CH3CH218OH $?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O,分液类型为 酯化反应(取代反应),
故答案为:羟基、羧基; CH3COOH+CH3CH218OH $?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O; 酯化反应(取代反应);
(2)将干燥管的末端插入了饱和碳酸钠溶液中,在此处球形干燥管的作用除了使乙酸乙酯充分冷凝外还有防倒吸作用,加热一段时间后,可观察到烧杯D中液面上层有无色油状液体乙酸乙酯生成,若分离该液体混合物的操作为分液,需要用到的玻璃仪器是分液漏斗,
故答案为:防倒吸;上;分液漏斗;分液;
(3)用氯化钙除去少量乙醇,过滤分离出乙醇(或CaCl2•6C2H5OH),用无水硫酸钠除去少量的水,无水硫酸钠吸水形成硫酸钠结晶水合物;乙酸乙酯的沸点为77℃,所以收集77℃左右的馏分,以得较纯净的乙酸乙酯,
故答案为:乙醇(或CaCl2•6C2H5OH);77.1℃;
(4)乙酸可使紫色石蕊试液变红,说明乙酸具有酸性,乙酸与碳酸钠溶液反应,乙酸酸性大于碳酸,分液生成二氧化碳气体,反应的离子方程式:2CH3COOH+CO32-=2CH3COO?+H2O+CO2↑,
故答案为:酸;2CH3COOH+CO32-=2CH3COO?+H2O+CO2↑.
点评 本题考查有机物的制备实验,为高频考点,把握反应原理、平衡移动、有机物的性质为解答的关键,侧重分析与应用能力的考查,注意表格中数据的分析与应用,题目难度中等.

| A. | F>P>M>N>E | B. | E>N>M>P>F | C. | P>F>N>M>E | D. | E>P>F>M>N |
| 温度 | CH4(g) | H2O(g) | CO(g) | H2(g) |
| 500K | 0.8mol/L | 0.8mol/L | 0.2mol/L | 0.6mol/L |
| 800K | 0.6mol/L | 0.6mol/L | 0.4mol/L | 1.2mol/L |
| 1000K | 0.4mol/L | 0.4mol/L | 0.6mol/L | 1.8mol/L |
(2)能判断该反应是否已达到化学平衡状态的依据是ad
a.容器压强不变 b.c(CH4)=c(H2O)
c.v正(CH4)=v逆(H2) d.混合气体中c(CO)不变
氮化铝是共价键化合物,高碳热还原制备氮化铝的总反应化学方程式为(未配平):
Al2O3(s)+C(s)+N2(g)→AlN(s)+CO(g) …①
某氮化铝样品中含有氧化铝杂质.已知氮化铝和NaOH溶液能反应,并产生氨气,其反应方程式为:AlN+NaOH+H2O→NaAlO2+NH3↑…②,
氧化铝也能与氢氧化钠溶液反应而全部溶解…③
(3)配平化学化学方程式①:1Al2O3(s)+3C(s)+1N2(g)→2AlN(s)+3CO(g)
(4)反应②中产生气体的检验方法为湿润的红色石蕊试纸遇到气体变蓝;反应③的离子方程式Al2O3+2OH-=2AlO2-+H2O.
| A. | KClO3在反应中失去电子 | |
| B. | H2C2O4在反应中被氧化 | |
| C. | ClO2是氧化产物 | |
| D. | 每消耗122.5 g KClO3就有2 mol电子转移 |
| A. | 常温下,4gCH4中含有NA个C一H | |
| B. | 1molNa2O2固体中有含有离子总数为4NA | |
| C. | 100mol l8.4mol/L的浓硫酸与足量铜在加热条件下充分反应,转移电子1.84NA | |
| D. | l0gD2O中含有中子数4NA |
| A. | Na2CO3 | B. | NH4Cl | C. | CH3COONa | D. | H2SO4 |
| A. | 含17个中子的镁元素的核素符号:${\;}_{17}^{29}$Mg | |
| B. | CH4分子的比例模型: | |
| C. | S2-离子的结构示意图: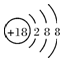 | |
| D. | HF的电子式: |
 ,B原子的核外电子排布式1s22s22p63s23p2,C原子的价电子排布式为3s23p5.
,B原子的核外电子排布式1s22s22p63s23p2,C原子的价电子排布式为3s23p5. ,中心原子A的杂化方式sp3杂化,是非极性(填“极性”或“非极性”)分子.
,中心原子A的杂化方式sp3杂化,是非极性(填“极性”或“非极性”)分子.
 +CH3OH+NaCl
+CH3OH+NaCl
 +nCH3OH
+nCH3OH