题目内容
4.下列化学方程式与结论均正确的是( )| 选项 | 方程式 | 结论 |
| A | 2AgI(s)+S2-(aq)?Ag2S(s)+2I-(aq) | 溶解度:Ag2S>AgI |
| B | C(s.石墨)═C(s.金刚石)△H>0 | 稳定性:金刚石>石墨 |
| C | 3Fe2++NO${\;}_{3}^{-}$+10H+═3Fe3++3H2O+NH${\;}_{4}^{+}$ | 还原性:Fe2+>NH${\;}_{4}^{+}$ |
| D | 2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;Fe+S$\frac{\underline{\;加热\;}}{\;}$FeS | 氧化性:Cl2>S |
| A. | A | B. | B | C. | C | D. | D |
分析 A.溶解度大的物质能转化为溶解度小的物质;
B.物质的能量越高,该物质越不稳定;
C.同一氧化还原反应中,还原剂的还原性大于还原产物的还原性;
D.与同一种金属反应,能将变价金属氧化为较高价态的非金属氧化性较强.
解答 解:A.溶解度大的物质能转化为溶解度小的物质,2AgI(s)+S2-(aq)?Ag2S(s)+2I-(aq),溶解度AgI>Ag2S,故A错误;
B.物质的能量越高,该物质越不稳定,C(s.石墨)═C(s.金刚石)△H>0,石墨的能量小于金刚石,所以稳定性石墨>金刚石,故B错误;
C.同一氧化还原反应中,还原剂的还原性大于还原产物的还原性,该反应中Fe元素化合价由+2价变为+3价、N元素化合价由+5价变为-3价,则亚铁离子是还原剂、铵根离子是还原产物,则还原性:Fe2+>NH4+,但转移电子不守恒,离子方程式为8Fe2++10H++NO3-=8Fe3++NH4++3H2O,故C错误;
D.同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,根据方程式知,氯气能将Fe氧化为高价态、S能将Fe氧化为低价态,所以氯气氧化性大于S,故D正确;
故选D.
点评 本题考查化学方程式的书写,为高频考点,涉及氧化性和还原性强弱比较、物质稳定性判断、物质溶解度大小判断,明确物质性质是解本题关键,易错选项是C,题目难度不大.

练习册系列答案
相关题目
14.光导纤维的应用使人们可以在家中坐享“互联网+”带来的变革与实惠,下列物质中可以用来生产光导纤维的是( )
| A. | 硫 | B. | 二氧化硅 | C. | 铁 | D. | 氧化铝 |
12.用摩尔(mol)作为单位的基本物理量是( )
| A. | 长度 | B. | 质量 | C. | 数量 | D. | 物质的量 |
16.以下化学用语中,正确的是( )
| A. | 氯化钠的分子式:NaCl | B. | 苯的结构简式: | ||
| C. | 甲烷的电子式: | D. | 乙醛分子的结构式: |
14.下列说法正确的是( )


| A. | 用甲图装置电解精炼镁 | |
| B. | 用乙图装置验证试管中铁丝发生析氢腐蚀 | |
| C. | 用丙图装置构成铜锌原电池 | |
| D. | 用丁图装置对充电电池进行充电 |
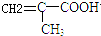 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$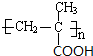 .
.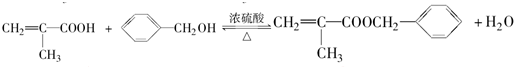 .
.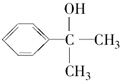 .
.