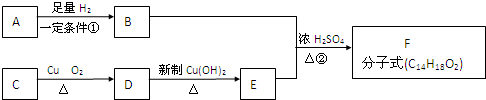
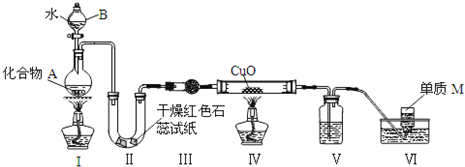
题目内容
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、在H2O2+Cl2→2HCl+O2反应中,每生成32 g氧气,则转移4NA个电子 |
| B、9克甲基中含有的电子数为10NA |
| C、常温常压下,46克二氧化氮和四氧化二氮混合物中含3NA个原子 |
| D、1mol含五个碳原子的有机物,最多形成4mol碳碳单键 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、氧元素化合价-1价变化为-2价,32g氧气物质的量为1mol,结合化学方程式定量关系计算电子转移;
B、依据n=
计算物质的量,结合甲基是中性原子团含有电子数9;
C、二氧化氮和四氧化二氮最简式为NO2,计算46gNO2中含有的原子数分析;
D、1mol含五个碳原子的有机物,连接形成环烷烃,最多形成5mol碳碳单键.
B、依据n=
| m |
| M |
C、二氧化氮和四氧化二氮最简式为NO2,计算46gNO2中含有的原子数分析;
D、1mol含五个碳原子的有机物,连接形成环烷烃,最多形成5mol碳碳单键.
解答:
解:A、氧元素化合价-1价变化为-2价,32g氧气物质的量为1mol,结合化学方程式定量关系计算电子转移2mol电子即2NA个,故A错误;
B、依据n=
计算物质的量=
,结合甲基是中性原子团含有电子数9,9克甲基中含有的电子数为
×9×NA=5.4NA,故错误;
C、二氧化氮和四氧化二氮最简式为NO2,计算46gNO2中含有的原子数=
×3×NA=3NA,故C正确;
D、1mol含五个碳原子的有机物,连接形成环烷烃,最多形成5mol碳碳单键,故D错误;
故选C.
B、依据n=
| m |
| M |
| 9g |
| 15g/mol |
| 9g |
| 15g/mol |
C、二氧化氮和四氧化二氮最简式为NO2,计算46gNO2中含有的原子数=
| 46g |
| 46g/mol |
D、1mol含五个碳原子的有机物,连接形成环烷烃,最多形成5mol碳碳单键,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是氧化还原反应电子转移计算,物质的量计算微粒数的应用,物质结构特征,掌握基础是关键,铁较简单.

练习册系列答案
相关题目
铅蓄电池是最重要的二次电池,其正极板上覆盖有PbO2,负极板上覆盖有Pb,电解质是硫酸溶液,下列说法不正确的是( )
| A、充电时转移1mol电子则生成0.5mol H2SO4 |
| B、放电时正极的电极反应为:PbO2+4H++SO42-+2e-=PbSO4+2H2O |
| C、充电时,电池上标注“+”的电极应与外接电源的正极相连 |
| D、放电时,Pb失电子发生氧化反应 |
下列说法正确的是( )
| A、焓是一个物理量,符号为H,单位为mol?L可以测量 |
| B、焓变就是反应热,二者没有区别 |
| C、公式△H--T△S中的△H是反应的焓变 |
| D、焓变△H只有大小,没有正负之分 |
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-Q1 kJ/mol
2H2(g)+O2(g)=2H2O(g);△H=-Q2 kJ/mol
2H2(g)+O2(g)=2H2O(l);△H=-Q3 kJ/mol
取体积比4:1的混合气112L(标况),完全燃烧后恢复到常温,放出热量为( )
2H2(g)+O2(g)=2H2O(g);△H=-Q2 kJ/mol
2H2(g)+O2(g)=2H2O(l);△H=-Q3 kJ/mol
取体积比4:1的混合气112L(标况),完全燃烧后恢复到常温,放出热量为( )
| A、4Q1+0.5Q3 |
| B、4Q1+0.5Q2 |
| C、4Q1+Q3 |
| D、4Q1+2Q2 |
下列物质中既属于无机物,又属于碱的是( )
| A、Na2CO3 |
| B、Cu2(OH)2CO3 |
| C、CH3CH2OH |
| D、Mg(OH)2 |
下列离子方程式书写正确的是( )
| A、在FeCl3溶液中加入铁粉:Fe3++Fe=2Fe2+ |
| B、锌与18.4mol?L的H2SO4溶液反应:Zn+2H+=Zn2++H2↑ |
| C、用NaOH溶液吸收氯气:C12+2OH-=Cl-+ClO-+H2O |
| D、稀H2SO4与Ba(OH)2溶液反应:Ba2++OH-+SO42-+H+=BaSO4↓+H2O |