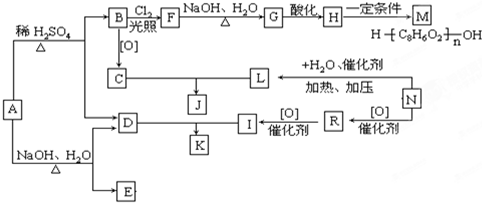
题目内容
铅蓄电池是最重要的二次电池,其正极板上覆盖有PbO2,负极板上覆盖有Pb,电解质是硫酸溶液,下列说法不正确的是( )
| A、充电时转移1mol电子则生成0.5mol H2SO4 |
| B、放电时正极的电极反应为:PbO2+4H++SO42-+2e-=PbSO4+2H2O |
| C、充电时,电池上标注“+”的电极应与外接电源的正极相连 |
| D、放电时,Pb失电子发生氧化反应 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:铅蓄电池的工作原理:Pb+PbO2+2H2SO4
2PbSO4+2H2O放电时,该装置是原电池,负极上铅失电子发生氧化反应,正极上二氧化铅得电子发生还原反应,根据电池总反应可知反应消耗硫酸,结合电极反应式以及电子转移情况分析判断.
| ||
| 充电 |
解答:
解:A、Pb+PbO2+2H2SO4
2PbSO4+2H2O转移电子是2mol,所以充电时转移1mol电子则生成1mol H2SO4,故A错误;
B、放电时,该装置是原电池,正极上二氧化铅得电子发生还原反应,则正极发生的反应是PbO2+4H++SO42-+2e-=PbSO4(s)+2H2O,故B正确;
C、充电时,电池上标注“+”的电极应与外接电源的正极相连,故C正确;
D、放电时,铅失电子发生氧化反应,其电极反应为Pb+SO42-+2e-═PbSO4,故D正确;
故选A.
| ||
| 充电 |
B、放电时,该装置是原电池,正极上二氧化铅得电子发生还原反应,则正极发生的反应是PbO2+4H++SO42-+2e-=PbSO4(s)+2H2O,故B正确;
C、充电时,电池上标注“+”的电极应与外接电源的正极相连,故C正确;
D、放电时,铅失电子发生氧化反应,其电极反应为Pb+SO42-+2e-═PbSO4,故D正确;
故选A.
点评:本题考查了原电池和电解池原理,难点是电极反应式的书写,根据得失电子结合电解质溶液写电极反应式,题目难度不大.

练习册系列答案
相关题目
将pH=11NaOH溶液和pH=3的甲酸溶液混合后,对所得溶液呈中性,下列判断一定正确的是( )
| A、c(HCOO-)<c(Na+) |
| B、c(HCOO-)>c(Na+) |
| C、c(HCOO-)=c(Na+) |
| D、c(Na+)=c(HCOO-)+c(HCOOH) |
危险化学品的包装标签上要印有警示性标志.下列物质选用如图标志的是( )


| A、汽油 | B、食盐 | C、浓硫酸 | D、炸药 |
维生素E是一种脂溶性维生素,对抗衰老等有特殊作用,经研究发现维生素E有α、β、γ、δ四种类型,其结构简式如图所示(R为-CH2CH2CH2[CH(CH3)CH2CH2]2CH(CH3)2). 上述互为同分异构体的是( )


| A、α β |
| B、β γ |
| C、γδ |
| D、α δ |
决定金属还原性强弱的主要因素是( )
| A、1个金属原子失去电子的多少 |
| B、1摩金属失去电子的多少 |
| C、原子失去电子能力的大小 |
| D、1摩金属与水反应放出H2的多少 |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、在H2O2+Cl2→2HCl+O2反应中,每生成32 g氧气,则转移4NA个电子 |
| B、9克甲基中含有的电子数为10NA |
| C、常温常压下,46克二氧化氮和四氧化二氮混合物中含3NA个原子 |
| D、1mol含五个碳原子的有机物,最多形成4mol碳碳单键 |