题目内容
 W、X、Y、Z、M、Q均为除稀有气体外分布在3个不同短周期元素,其原子序数依次增大,X的最外层电子数是W的4倍,Z与M的最低负化合价相同,X、M在周期表中位置如图所示.
W、X、Y、Z、M、Q均为除稀有气体外分布在3个不同短周期元素,其原子序数依次增大,X的最外层电子数是W的4倍,Z与M的最低负化合价相同,X、M在周期表中位置如图所示.(1)Q在周期表中的位置为
(2)Z与W形成的4核分子的结构式为
(3)由W、Y、Z、M组成的离子化合物在溶液中相互反应的离子方程式为:
(4)W2与Z2反应生成化合物甲,W2与Q2反应生成化合物乙.
已知反应:乙(g)+Z2(g)→甲(g)+Q2(g),每生成1mol Q2放热57.8kJ.写出该反应的热化学方程式:
(5)X、Y可分别与Z以原子个数比1:1形成化合物丙和丁.在催化剂存在条件下,丙与丁发生可逆反应,生成单质Y2和另一种化合物戊.写出该反应的化学方程式:
(6)将1mol丙气体和1mol丁气体充入一装有催化剂的恒压容器中,充分反应达平衡后:
①若气体体积较原来减少20%,则丁的转化率为
②若仅将压强缩小为原来的一半,再次达平衡后,混合气体中丁的体积分数将
考点:元素周期律和元素周期表的综合应用,热化学方程式,化学平衡常数的含义,化学平衡的计算
专题:化学反应中的能量变化,元素周期律与元素周期表专题,化学平衡专题
分析:W、X、Y、Z、M、Q均为除稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的4倍,则W最外层电子数只能为1,X的最外层电子数为4,由X、M元素在周期表中的位置可知,X处于第二周期,故X为C元素、M为S元素;Z与M的最低负化合价相同,二者为同主族元素,可推知Z为O元素;结合原子序数可知Y为N、Q为Cl;由于元素分布在3个不同短周期,推知W为H,据此解答.
解答:
解:W、X、Y、Z、M、Q均为除稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的4倍,则W最外层电子数只能为1,X的最外层电子数为4,由X、M元素在周期表中的位置可知,X处于第二周期,故X为C元素、M为S元素;Z与M的最低负化合价相同,二者为同主族元素,可推知Z为O元素;结合原子序数可知Y为N、Q为Cl;由于元素分布在3个不同短周期,推知W为H,
(1)Q为Cl,原子核外有3个电子层,最外层电子数为7,在周期表中的位置为第三周期第VIIA族,
故答案为:第三周期第VIIA族;
(2)O与H形成的4核分子为H2O2,分子中O原子之间形成1对共用电子对、O原子与H原子之间形成1度共用电子对,故其结构式为H-O-O-H,
故答案为:H-O-O-H;
(3)由H、N、O、S组成的离子化合物在溶液中相互反应,应为NH4HSO3[或(NH4)2SO4]与NH4HSO4,二者反应离子方程式为:HSO3-+H+=SO2↑+H2O或SO32-+2H+=SO2↑+H2O,
故答案为:HSO3-+H+=SO2↑+H2O或SO32-+2H+=SO2↑+H2O;
(4)H2与O2反应生成化合物甲为H2O,H2与Cl2反应生成化合物乙为HCl,已知:HCl(g)+O2(g)→H2O(g)+Cl2(g),每生成1mol Cl2放热57.8kJ,则该反应的热化学方程式为:2HCl(g)+
O2(g)=H2O(g)+Cl2(g)△H=-57.8 kJ/mol,
故答案为:2HCl(g)+
O2(g)=H2O(g)+Cl2(g)△H=-57.8 kJ/mol;
(5)C、N可分别与O以原子个数比1:1形成化合物丙和丁,则丙为CO、丁为NO,在催化剂存在条件下,丙与丁发生可逆反应,生成单质N2和另一种化合物戊,根据元素守恒及电子转移守恒可知戊为CO2,该反应的化学方程式:2CO+2NO N2+2CO2,该反应的平衡常数表达式k=
N2+2CO2,该反应的平衡常数表达式k=
,
故答案为:2CO+2NO N2+2CO2;
N2+2CO2;
;
(6)将1molCO气体和1molNO气体充入一装有催化剂的恒压容器中,充分反应达平衡后:
①若气体体积较原来减少20%,则混合气体减少物质的量=(1mol+1mol)×20%=0.4mol,则:
2CO+2NO N2+2CO2 气体物质的量减少
N2+2CO2 气体物质的量减少
2 1
n(NO) 0.4mol
故n(NO)=
=0.8mol,
则NO的转化率=
×100%=80%,
故答案为:80%;
②若仅将压强缩小为原来的一半,平衡向逆反应方向移动,混合气体每增大1mol,NO物质的量增大2mol,故再次达平衡后,混合气体中NO的体积分数将变大,
故答案为:变大.
(1)Q为Cl,原子核外有3个电子层,最外层电子数为7,在周期表中的位置为第三周期第VIIA族,
故答案为:第三周期第VIIA族;
(2)O与H形成的4核分子为H2O2,分子中O原子之间形成1对共用电子对、O原子与H原子之间形成1度共用电子对,故其结构式为H-O-O-H,
故答案为:H-O-O-H;
(3)由H、N、O、S组成的离子化合物在溶液中相互反应,应为NH4HSO3[或(NH4)2SO4]与NH4HSO4,二者反应离子方程式为:HSO3-+H+=SO2↑+H2O或SO32-+2H+=SO2↑+H2O,
故答案为:HSO3-+H+=SO2↑+H2O或SO32-+2H+=SO2↑+H2O;
(4)H2与O2反应生成化合物甲为H2O,H2与Cl2反应生成化合物乙为HCl,已知:HCl(g)+O2(g)→H2O(g)+Cl2(g),每生成1mol Cl2放热57.8kJ,则该反应的热化学方程式为:2HCl(g)+
| 1 |
| 2 |
故答案为:2HCl(g)+
| 1 |
| 2 |
(5)C、N可分别与O以原子个数比1:1形成化合物丙和丁,则丙为CO、丁为NO,在催化剂存在条件下,丙与丁发生可逆反应,生成单质N2和另一种化合物戊,根据元素守恒及电子转移守恒可知戊为CO2,该反应的化学方程式:2CO+2NO
 N2+2CO2,该反应的平衡常数表达式k=
N2+2CO2,该反应的平衡常数表达式k=| c(N2)?c2(CO2) |
| c2(CO)?c2(NO) |
故答案为:2CO+2NO
 N2+2CO2;
N2+2CO2;| c(N2)?c2(CO2) |
| c2(CO)?c2(NO) |
(6)将1molCO气体和1molNO气体充入一装有催化剂的恒压容器中,充分反应达平衡后:
①若气体体积较原来减少20%,则混合气体减少物质的量=(1mol+1mol)×20%=0.4mol,则:
2CO+2NO
 N2+2CO2 气体物质的量减少
N2+2CO2 气体物质的量减少2 1
n(NO) 0.4mol
故n(NO)=
| 0.4mol×2 |
| 1 |
则NO的转化率=
| 0.8mol |
| 1mol |
故答案为:80%;
②若仅将压强缩小为原来的一半,平衡向逆反应方向移动,混合气体每增大1mol,NO物质的量增大2mol,故再次达平衡后,混合气体中NO的体积分数将变大,
故答案为:变大.
点评:本题考查元素化合物推断、结构式、离子方程式、热化学方程式、化学平衡常数、化学平衡计算等,推断元素是解题的关键,根据最外层电子数关系确定X为突破口,难度中等.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
关于下列四个说法正确的是( )
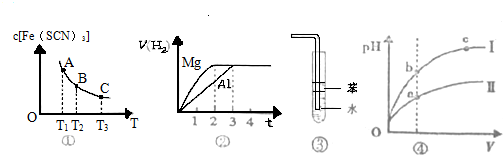

| A、已知图①是体系Fe3++3SCN-?Fe(SCB)3中c[Fe(SCN)3]与温度T的平衡图象,则A点与B点相比,A点的Fe3+浓度大 |
| B、图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V(H2) 与时间t的关系.则反应中镁和铝的反应速率之比为2:3 |
| C、图③可用于吸收HCl气体,并防倒吸 |
| D、图④是某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线,II为醋酸稀释时pH的变化曲线 |
已知:同温度下的溶解度Zn(OH)2>ZnS>MgCO3>Mg(OH)2,就溶解或电离出S2-的能力而言,FeS>H2S>CuS则以下离子方程式错误的是( )
| A、Mg2++2HCO3-+Ca2++2OH-=MgCO3↓+CaCO3↓+2H2O |
| B、Cu2++H2S=Cu S↓+2H+ |
| C、Zn2++S2-+2H2O=Zn(OH)2↓+H2S↑ |
| D、FeS+2H+=Fe2++H2S↑ |
下列各物质之间的反应属于置换反应的是( )
| A、CO还原氧化铜 |
| B、钠与稀盐酸反应 |
| C、铁与稀硝酸反应 |
| D、碳与浓硫酸反应 |

 将2mol SO2和1mol O2混合置于体积可变的密闭容器中,在T1温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0,当反应进行到时间t0点时达到平衡状态,测得混合气体的总物质的量为2.1mol.试回答:
将2mol SO2和1mol O2混合置于体积可变的密闭容器中,在T1温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0,当反应进行到时间t0点时达到平衡状态,测得混合气体的总物质的量为2.1mol.试回答: