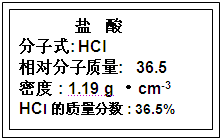
题目内容
在一小烧杯中盛有100 mL 2 mol·L-1的硫酸溶液,同时有一表面光滑的塑料小球悬浮于溶液中.现向该溶液中缓慢注入0.4 mol·L-1的Ba(OH)2溶液至恰好反应完全,在此实验过程中:
(1)烧杯里观察到的现象有__________________________.
(2)产生此现象的原因是____________________________.
答案:
解析:
解析:
|
答案:(1)有白色沉淀生成,小球逐渐下沉到烧杯底部 (2)随着反应的进行,硫酸被逐渐消耗,至沉淀完全时,液体中只有水,其密度小于原硫酸溶液,故而小球下沉. 解析:由于H2SO4+Ba(OH)2 |

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目