题目内容
4.化学与人类生活密切相关.请按要求,回答下列问题:(1)酸雨的pH小于5.6.
(2)漂白粉有效成分的化学式为Ca(ClO)2,其能消毒杀菌是因有强氧化性.
(3)小苏打可用于治疗胃酸过多,其反应的离子方程式为HCO3-+H+=CO2↑+H2O.
(4)KA1(SO4)2•12H2O的俗名为明矾,因其溶于水生成Al(OH)3(化学式)而具有净水作用.
(5)向一铝制易拉罐中充满CO2后,再往罐中注入足量的质量分数为20%的NaOH溶液,立即严封罐口,不-会儿就发现易拉罐变瘪,再过一会易拉罐又鼓胀起来,解释上述实验现象,易拉罐又鼓胀起来的原因是2Al+2NaOH+2H2O=2NaAlO2+3H2↑(用化学方程式表示).
分析 (1)CO2溶于水形成碳酸,饱和碳酸溶液的pH=5.6,二氧化硫溶于水生成亚硫酸,空气中亚硫酸被氧化为硫酸;
(2)漂白粉制备是氯气和氢氧化钙反应生成次氯酸钙、氯化钙和水,其中次氯酸钙具有强氧化性具有漂白作用;
(3)小苏打可用于治疗胃酸过多是碳酸氢钠和盐酸反应;
(4)KA1(SO4)2•12H2O为明矾晶体,溶于水溶液中铝离子水解生成氢氧化铝胶体具有吸附悬浮杂质的作用;
(5)二氧化碳被氢氧化钠吸收易拉罐变瘪,铝和氢氧化钠溶液反应生成氢气,易拉罐又鼓胀起来.
解答 解:(1)CO2溶于水形成碳酸,饱和碳酸溶液的pH=5.6,酸雨是二氧化硫溶于水生成的亚硫酸被空气氧化深层次硫酸,溶液PH小于5.6,
故答案为:5.6;
(2)氯气与消石灰发生反应:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,产生漂白粉,漂白粉的主要成分是CaCl2和Ca(ClO)2的混合物,有效成分是Ca(ClO)2,它之所以能消毒杀菌是因有强的氧化性,
故答案为:Ca(ClO)2;氧化;
(3)NaHCO3与胃酸即盐酸发生复分解反应,产生CO2和水,反应的离子方程式是:HCO3-+H+=CO2↑+H2O,
故答案为:HCO3-+H+=CO2↑+H2O;
(4)KAl(SO4)2•12H2O的俗名为明矾,该盐是强酸弱碱盐,电离产生的Al3+与水电离产生的OH-结合形成表面积比较大的Al(OH)3胶体而有吸附作用,使水中悬浮的固体被吸附,当重力大于浮力时,就形成沉淀,从而使水变得澄清,因此有净水作用,
故答案为:明矾;Al(OH)3;
(5)金属铝能和强碱反应生成氢气,导致罐内气体压强又增大而重新鼓起,金属铝能和强碱反应是实质是:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
点评 本题考查了酸雨形成、|漂白粉制备、碳酸氢钠性质、铝及其化合物等知识点,注意知识积累,题目难度中等.

①乙酸和乙醇的酯化反应
②苯的硝化反应
③油脂的水解反应
④淀粉的水解反应.
| A. | ①④ | B. | ②④ | C. | ③④ | D. | ①③ |
| 成分 | Na+ | Mg2+ | Ca2+ | K+ | Li+ | Cl- | SO42- | Br- |
| 含量/mg•L-1 | 9965 | 1200 | 400 | 380 | 0.17 | 19350 | 1200 | 67 |
(2)①该海水中Mg2+的物质的量浓度为0.05mol/L.
②检验该海水中的Mg2+时,需要排除Ca2+可能带来的干扰,设计如下实验:
| 实验操作 | 实验现象 |
| Ⅰ.取1mL海水,加入1mL0.1mol/L的NaOH溶液 | 有白色沉淀 |
| Ⅱ.取1mLCaCl2溶液,加入1mL0.1mol/L的NaOH溶液 | 无白色沉淀 |

①沉淀池中反应的离子方程式为Mg2++2OH-=Mg(OH)2↓;
②操作a是蒸发浓缩、冷却结晶、过滤洗涤、干燥.
③操作b是在干燥的HCl气流中加热脱水,请解释“干燥的HCl气流”的作用:防止镁离子水解生成氢氧化镁,带走水蒸气.
(4)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.

①阳极的电极反应式为4OH--4e-=2H2O+O2↑.
②淡水的出口为a、b、c中的b出口.
| A. | 0.04mol/(L•s) | B. | 0.06mol/(L•s) | C. | 0.12mol/(L•s) | D. | 0.08mol/(L•s) |
| A. | 用电子式表示HCl的形成过程: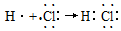 | |
| B. | ${\;}_{87}^{166}$Ho中的原子核内的中子数与核外电子数之差是99 | |
| C. | 在空气中加热金属锂:4Li+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Li2O | |
| D. | Na2O2与H2O2中所含的化学键类型不完全相同 |
| A. | 碳酸钙和稀盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═2Fe2++Fe3++4H2O | |
| C. | 将金属铝加入NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 金属钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ |
 乙二醛(OHC-CHO)是一种重要的精细化工产品.工业用乙二醇(HOCH2CH2OH)氧化法生产乙二醛.
乙二醛(OHC-CHO)是一种重要的精细化工产品.工业用乙二醇(HOCH2CH2OH)氧化法生产乙二醛. +2NH2OH•HCl→
+2NH2OH•HCl→ +2HCL+2H2O)
+2HCL+2H2O) 某化学实验小组用右图所示的装置制取乙酸乙酯,并检验乙酸乙酯中是否含有乙酸杂质(铁架台、夹子等支撑仪器省略).已知乙酸乙酯的沸点为77.1℃,乙醇沸点为78.4℃,乙酸的沸点为118℃.请根据要求填空:
某化学实验小组用右图所示的装置制取乙酸乙酯,并检验乙酸乙酯中是否含有乙酸杂质(铁架台、夹子等支撑仪器省略).已知乙酸乙酯的沸点为77.1℃,乙醇沸点为78.4℃,乙酸的沸点为118℃.请根据要求填空: