题目内容
19.在一定条件下,密闭容器中进行反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g).反应开始时NH3的浓度是1.0mol/L,经过20s后,它的浓度变成了0.2mol/L,容器体积不变,在这20s内H2O的化学反应速率为( )| A. | 0.04mol/(L•s) | B. | 0.06mol/(L•s) | C. | 0.12mol/(L•s) | D. | 0.08mol/(L•s) |
分析 结合v=$\frac{△c}{△t}$、速率之比等于化学计量数之比来解答.
解答 解:开始时NH3的浓度是1.0mol/L,经过20s后,它的浓度变成了0.2mol/L,v(NH3)=$\frac{1.0mol/L-0.2mol/L}{20s}$=0.04mol/(L•s),
速率之比等于化学计量数之比,则v(H2O)=0.04mol/(L•s)×$\frac{6}{4}$=0.06mol/(L•s),
故选B.
点评 本题考查反应速率,为高频考点,把握速率计算、速率与化学计量数的关系为解答的关键,侧重分析与应用能力的考查,注意速率为平均速率,题目难度不大.

练习册系列答案
相关题目
9.1868年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学史上的重要里程碑之一.下列有关元素周期表的说法不正确的是( )
| A. | 迄今人类发现的元素中,金属元素和非金属元素种数相近 | |
| B. | 元素周期表有18个纵行16个族,分为主族、副族、第Ⅷ族和零族 | |
| C. | 元素周期表有七个周期,分为短周期和长周期 | |
| D. | 人们在周期表中金属与非金属的分界处可以找到半导体材料,如硅、锗等 |
14.下列说法不正确的是( )
| A. | 聚乙烯制成的塑料可以反复加热熔融,是热塑性材料 | |
| B. | 用碱催化生成的酚醛树脂能形成网状结构,不溶于任何溶剂 | |
| C. | 在制备高吸水性树脂时要加入交联剂,以得到具有网状结构的树脂 | |
| D. | 天然纤维的主要成分都是纤维素 |
16.已知Fe3+能将I-氧化成I2,现将0.1mol•L-1FeCl3溶液和0.2mol•L-1KI溶液等体积充分混合,然后取混合液分别进行下列实验,能说明溶液中存在化学平衡2Fe3++2I-?2Fe2++I2的是( )
| 实验操作 | 实验现象 | |
| A | 滴入淀粉溶液 | 溶液变蓝色 |
| B | 滴入AgNO3溶液 | 有黄色沉淀生成 |
| C | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
| D | 滴入KSCN溶液 | 溶液变红色 |
| A. | A | B. | B | C. | C | D. | D |

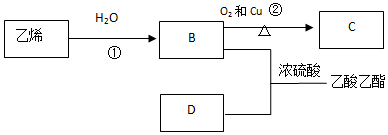
 在试管a中先加入2mL 95%的乙醇,边摇动边缓缓加入5mL浓H2SO4并充分摇匀,冷却后再加入2g无水醋酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液.连接好装置,用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.
在试管a中先加入2mL 95%的乙醇,边摇动边缓缓加入5mL浓H2SO4并充分摇匀,冷却后再加入2g无水醋酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液.连接好装置,用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.