题目内容
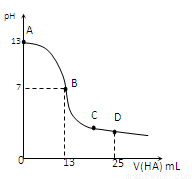
常温下,向25 mL 0.1 mol/L MOH溶液中逐滴加入0.2 mol/L HA溶液,曲线如图所示(体积变化忽略不计)。回答下列问题: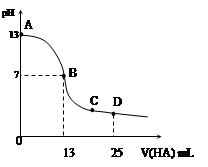
(1)写出MOH在水溶液中的电离方程式
(2)MOH与HA恰好完全反应时,溶液呈_____性(填“酸”、“碱”或“中”),理由是(用离子方程式表示)__ _____;此时,混合溶液中由水电离出的c(H+)__ _ 0.2 mol/L HA溶液中由水电离出的c(H+)(填“>”“<”或“=”)。
(3)写出B点混合溶液中各离子浓度的大小关系_________ _;
(4)D点时,溶液中c(A-)+c(HA)________2 c(M+)(填“>”“<”或“=”);若此时测得混合溶液的pH = 3,则 c(HA) + c(H+) = __________mol/L(数字表达式,不必具体算出结果)
(10分)(1)MOH=M++OH-(2)碱;A-+H2O OH-+HA
OH-+HA 
(3)c(M+)=c(A-)>c(OH-)=c(H+) (4)= 0.05+
解析试题分析:(1)根据图像可知,0.1 mol/L MOH溶液中pH=13,这说明是强健,所以电离方程式是MOH=M++OH-。
(2)根据图像可知,当加入HA溶液的体积是13ml时,溶液显中性,但此时HA是过量的。这说明当二者恰好反应时,溶液显碱性,因此HA是弱酸,生成的MA水解溶液显碱性,水解方程式是A-+H2O OH-+HA。水解促进水的电离,酸抑制水的电离,所以混合溶液中由水电离出的c(H+)>0.2 mol/L HA溶液中由水电离出的c(H+)。
OH-+HA。水解促进水的电离,酸抑制水的电离,所以混合溶液中由水电离出的c(H+)>0.2 mol/L HA溶液中由水电离出的c(H+)。
(3)B点溶液显中性,则根据电荷守恒可知,B点混合溶液中各离子浓度的大小关系是c(M+)=c(A-)>c(OH-)=c(H+)。
(4)D点时,溶液中含有等量的HA和MA,则根据物料守恒可知c(A-)+c(HA)=2 c(M+)。根据电荷守恒可知c(M+)+c(H+)=c(A-)+c(OH-),则c(HA) + c(H+) = c(M+)+c(OH-)=0.05+ 。
。
考点:考查酸碱中和滴定、溶液酸碱性、溶液中离子浓度大小比较以及图像识别等
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,难易适中,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养。该题的关键是利用好电荷守恒、物料守恒等关系式,有利于培养学生的逻辑推理能力和创新思维能力。