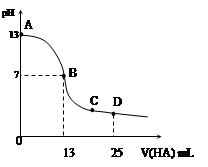题目内容
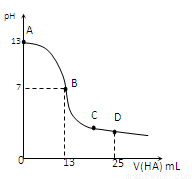
常温下,向25 mL 0.1 mol/L MOH溶液中逐滴加入0.2 mol/L HA溶液,曲线如图所示(体积变化忽略不计)。回答下列问题:
(1)写出MOH的电离方程式
(2)MOH与HA恰好完全反应时,溶液呈_____性(填“酸”、“碱”或“中”),理由是(用离子方程式表示)__ _____;
此时,混合溶液中由水电离出的c(H+)__ _ 0.2 mol/L HA溶液中由水电离出的c(H+)(填“>”“<”或“=”)。
(3)分别写出B、C两点,混合溶液中各离子浓度的大小关系
B点_____________ _;C点___ __________;
(4)D点时,溶液中c(A-)+c(HA)________2 c(M+)(填“>”“<”或“=”);若此时测得混合溶液的pH = 3,则 c(HA) + c(H+) =__________mol/L。
(1)MOH==M++OH-(2)碱;A—+ H2OHA +OH—;>
(3)c(M+) = c(A-)> c(H+) = c(OH-) ;c(A-)>c(M+)> c(H+)> c(OH-) (各3分)
(4)= ;0.05(由电荷守恒和物料守恒求得)
解析:略

练习册系列答案
相关题目