题目内容
18.CH4催化还原法.已知:①CH4(g)+4NO2(g)?4NO(g)+CO2(g)+2H2O(l)△H=-622kJ/mol
②CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(l)△H=-955kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
(5)写出CH4(g)与NO(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1200kJ/mol.
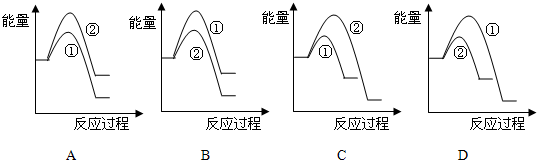
(6)假设在某温度下反应①的速率(v1)大于反应②的速率(v2)则下列反应过程能量变化示意图正确的是C(填写正确选项的字母).
分析 (5)已知①CH4(g)+4NO2(g)?4NO(g)+CO2(g)+2H2O(l)△H=-622kJ/mol;②CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(l)△H=-955kJ/mol;③H2O(g)=H2O(l)△H=-44.0kJ/mol,利用盖斯定理,将②×2-①-③×2可得CH4(g)与NO(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式;
(6)反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则反应Ⅱ的活化能较大;反应①②都为放热反应,且反应②放出的热量多,结合图象进行分析判断.
解答 解:(5)已知①CH4(g)+4NO2(g)?4NO(g)+CO2(g)+2H2O(l)△H=-622kJ/mol;②CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(l)△H=-955kJ/mol;③H2O(g)=H2O(l)△H=-44.0kJ/mol,利用盖斯定理,将②×2-①-③×2可得CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=[(-955kJ/mol)×2-(-622kJ/mol)-(-44.0kJ/mol)×2]=-1200kJ/mol,
故答案为:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1200kJ/mol;
(6)反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则反应Ⅱ的活化能较大,故B、D错误;反应①②都为放热反应,且反应②放出的热量多,故A错误,C正确;
故答案为:C.
点评 本题考查斯定律的应用、化学平衡移动的影响因素等知识,为高频考点,侧重考查学生的分析能力和计算能力的考查,注意把握盖斯定律的运用,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
| A. | CO2的电子式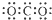 | B. | 质量数为37的氯原子${\;}_{37}^{17}$Cl | ||
| C. | 乙烯的结构简式C2H4 | D. | Cl-的结构示意图: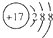 |
9.下列各组物质相互混合反应,既有气体生成,最终又一定有沉淀生成是( )
①金属钠投入FeCl3溶液中 ②少量电石投入过量碳酸氢钠溶液中
③过氧化钠投入AlCl3溶液中 ④碳酸钠投入明矾溶液中.
①金属钠投入FeCl3溶液中 ②少量电石投入过量碳酸氢钠溶液中
③过氧化钠投入AlCl3溶液中 ④碳酸钠投入明矾溶液中.
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
6.质量为ag的铜片在空气中灼烧变黑,趁热放入下列物质中后,质量大于ag的是( )
| A. | 盐酸 | B. | 无水乙醇 | C. | 澄清石灰水 | D. | 硫酸 |
3.NA为阿伏伽德罗常数的值,下列叙述错误的是( )
| A. | 两份质量均为27 g的 Al分别与足量NaOH溶液和足量的盐酸反应转移电子均为3NA | |
| B. | 1mol氯气与足量的铁反应,转移电子数目是3NA | |
| C. | 46 g NO2和N2O4混合气体中含有原子总数为3 NA | |
| D. | 23 g Na 与足量 O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
10.阿斯匹林的结构简式为: ,则1mol阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为( )
,则1mol阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为( )
 ,则1mol阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为( )
,则1mol阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为( )| A. | 1mol | B. | 2mol | C. | 3mol | D. | 4mol |
8.某化学反应的△H=-122kJ•mol-1,△S=+231J•mol-1•K-1,则此反应在下列哪种情况下可自发进行( )
| A. | 在任何温度下都能自发进行 | B. | 在任何温度下都不能自发进行 | ||
| C. | 仅在高温下自发进行 | D. | 仅在低温下自发进行 |