题目内容
1. 四川含有丰富的矿产资源,钒矿、钛矿、黄铁矿等七种矿产储量位居全国第1位.回答下列问题:
四川含有丰富的矿产资源,钒矿、钛矿、黄铁矿等七种矿产储量位居全国第1位.回答下列问题:(1)V2O5常用作SO2转化为SO3的催化剂.SO2 分子中键角< 120°(填“>”、“<”或“=”);SO3分子中S原子的杂化轨道类型为sp2;V2O5 溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为正四面体.
(2)VO2+在酸性条件下可被草酸(H2C2O4)还原为VO2+,草酸被氧化为CO2,该反应用于钒含量的测定.写出反应的离子方程式2VO2++H2C2O4+2H+=2VO2++2CO2↑+2H2O.
(3)钛在元素周期表中的位置为第四周期,第ⅣB族,其电子排布式为[Ar]3d24s2.用乙醚从TiCl3的饱和溶液中萃取可得TiCl3•6H2O绿色晶体,其配位数为6,将1mol该晶体加入到足量硝酸银溶液中可得2mol白色沉淀,则该配合物的化学式是[Ti(H2O)5Cl]Cl2•H2O.
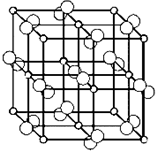
(4)科学家通过X射线探明,黄铁矿(FeS2)的晶体结构与NaCl的晶体结构相似,若在FeS2晶体中阴阳离子间最近距离为a cm,阿伏伽德罗常数为NA.则晶体密度表达式为$\frac{60}{{a}^{3}{N}_{A}}$g/cm3.
分析 (1)SO2分子中S原子价层电子对个数=2+$\frac{6-2×2}{2}$=3且含有1个孤电子对,为V形分子,孤电子对和成键电子对之间的排斥力大于成键电子对之间的排斥力;
SO3分子中S原子价层电子对个数=3+$\frac{6-3×2}{2}$=3且不含孤电子对,根据价层电子对互斥理论判断三氧化硫中S原子杂化方式;该阴离子中V原子价层电子对个数=4+$\frac{5+3-4×2}{2}$=4且不含孤电子对,根据价层电子对互斥理论判断该阴离子空间构型;
(2)酸性条件下,VO2+在酸性条件下可被草酸(H2C2O4)还原为VO2+,草酸被氧化为CO2,同时又水生成,根据转移电子守恒及原子守恒书写离子方程式;
(3)Ti位于第四周期IVB族;其原子核外有22个电子,3d、4s能级分别含有2个电子,根据构造原理书写其原子核外电子排布式;
用乙醚从TiCl3的饱和溶液中萃取可得TiCl3•6H2O绿色晶体,其配位数为6,将1mol该晶体加入到足量硝酸银溶液中可得2mol白色沉淀,说明该化学式中含有2个氯离子,剩余1个氯原子为配原子,因为其配位数是5,所以还有5个水分子是配体,1个水分子是结晶水;
(4)根据图知,该晶胞中S22-个数=1+12×$\frac{1}{4}$=4、亚铁离子个数=6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,该晶胞体积=(2acm)3,晶胞密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$.
解答 解:(1)SO2分子中S原子价层电子对个数=2+$\frac{6-2×2}{2}$=3且含有1个孤电子对,为V形分子,孤电子对和成键电子对之间的排斥力大于成键电子对之间的排斥力,所以SO2 分子中键角<120°;
SO3分子中S原子价层电子对个数=3+$\frac{6-3×2}{2}$=3且不含孤电子对,根据价层电子对互斥理论判断三氧化硫中S原子杂化方式为sp2;该阴离子中V原子价层电子对个数=4+$\frac{5+3-4×2}{2}$=4且不含孤电子对,根据价层电子对互斥理论判断该阴离子空间构型为正四面体;
故答案为:<;sp2;正四面体;
(2)酸性条件下,VO2+在酸性条件下可被草酸(H2C2O4)还原为VO2+,草酸被氧化为CO2,同时又水生成,V元素化合价由+5价变为+4价、C元素化合价由+3价变为+4价,转移电子数为2,根据转移电子守恒、原子守恒配平离子方程式为2VO2++H2C2O4+2H+=2 VO2++2 CO2↑+2 H2O,
故答案为:2VO2++H2C2O4+2H+=2 VO2++2 CO2↑+2 H2O;
(3)Ti位于第四周期IVB族;其原子核外有22个电子,3d、4s能级分别含有2个电子,根据构造原理书写其原子核外电子排布式为[Ar]3d24s2;
用乙醚从TiCl3的饱和溶液中萃取可得TiCl3•6H2O绿色晶体,其配位数为6,将1mol该晶体加入到足量硝酸银溶液中可得2mol白色沉淀,说明该化学式中含有2个氯离子,剩余1个氯原子为配原子,因为其配位数是5,所以还有5个水分子是配体,1个水分子是结晶水,其化学式为[Ti(H2O)5Cl]Cl2•H2O,
故答案为:第四周期,第ⅣB族;[Ar]3d24s2;[Ti(H2O)5Cl]Cl2•H2O;
(4)根据图知,该晶胞中S22-个数=1+12×$\frac{1}{4}$=4、亚铁离子个数=6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,该晶胞体积=(2acm)3,晶胞密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{120}{{N}_{A}}×4}{(2a)^{3}}$g/cm3=$\frac{60}{{a}^{3}{N}_{A}}$g/cm3,
故答案为:$\frac{60}{{a}^{3}{N}_{A}}$.
点评 本题考查物质结构和性质,为高考热点,涉及晶胞计算、配合物化学式确定、原子结构、微粒空间构型判断等知识点,综合性较强,侧重考查学生分析判断、计算及空间想象能力,难点是晶胞计算,知道晶胞公式含义,题目难度中等.

| A. | c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | B. | c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | ||
| C. | c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | D. | c(Na+)+c(OH-)=c(CH3COO-)+c(H+) |
| A. | H2SO4(aq) | B. | HCl(aq) | C. | Fe2(SO4)3(aq) | D. | CuSO4(aq) |