题目内容
6.化学与科学、技术、社会、环境密切相关,下列有关说法中错误的是( )| A. | 大量排放NO和NO2等氮氧化物是形成光化学烟雾和酸雨的一个重要原因 | |
| B. | 采用纳米二氧化钛光触媒技术,将汽车尾气中的NO和CO转化为无害气体 | |
| C. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遭遇强碱会“断路” | |
| D. | 大量燃烧化石燃料排放的废气中含大量SO2,从而使雨水的pH=5.6,形成酸雨 |
分析 A.NO和NO2等氮氧化物,为常见的空气污染物;
B.NO和CO转化为氮气和二氧化碳;
C.根据光导纤维的主要成分是二氧化硅以及二氧化硅能与氢氧化钠溶液反应,生成硅酸钠和水;
D.酸雨的pH<5.6.
解答 解:A.NO和NO2等氮氧化物,为常见的空气污染物,是形成光化学烟雾和酸雨的一个重要原因,故A正确;
B.采用纳米二氧化钛光触媒技术将汽车尾气中的NO和CO转化为氮气和二氧化碳,均为无毒物质,故B正确;
C.二氧化硅能用于制光导纤维、二氧化硅能与氢氧化钠溶液反应,生成硅酸钠和水,所以光导纤维遇强碱会“断路”,故C正确;
D.酸雨的pH<5.6,正常雨水的pH约为5.6,故D错误;
故选:D.
点评 本题考查了生活中常见的化学知识,涉及二氧化硫的性质、环境污染等,为高频考点,把握常见物质的性质、发生的化学反应及环境保护问题为解答的关键,题目难度不大.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
3.对于反应2SO2(气)+O2(气)$?_{△}^{催化剂}$2SO3(气),下列判断正确的是( )
| A. | 2mol SO2和足量的O2反应,必定生成2mol SO3 | |
| B. | 当v(正)>V(逆)时,随着反应的进行,反应物的物质的量逐渐减小 | |
| C. | 正反应速率之比为v(SO2):v(O2):v(SO3)=2:1:2时,反应达到平衡 | |
| D. | 反应达到平衡后,升高温度,平衡不一定发生移动 |
4.设NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 7.8g Na2S与Na2O2的混合物中阴离子数大于0.1NA | |
| B. | 标准状况下,22.4L NO和11.2L O2混合后气体的分子总数为2NA | |
| C. | T℃时,1L pH=6的某水溶液中,含1×10-8NA个OH- | |
| D. | 84g由碳酸镁和碳酸氢钠组成的混合物与足量盐酸反应生成CO2的体积为22.4L(标准状况下) |
14.将SO2通入到紫色的酸性高锰酸钾溶液中,观察到紫色退去,这是由于( )
| A. | SO2具有漂白性 | B. | SO2为酸性氧化物 | C. | SO2具有还原性 | D. | SO2具有氧化性 |
1.已知在常温下测得浓度均为0.1mol•L-1的下列四种溶液的pH如下表:
(1)用离子方程式表示NaClO溶液的pH=9.7的原因ClO-+H2O?HClO+OH-.
(2)根据盐溶液的pH,可知①Ka(HClO) ②Ka1(H2CO3) ③Ka(HF) ④Ka2(H2CO3)的大小顺序为③②①④.
(3)将少量CO2通入NaClO溶液中,写出该反应的离子方程式:CO2+H2O+ClO-=HClO+HCO3-.
(4)将CO2通入0.1mol•L-1的Na2CO3溶液中至中性,则溶液中2c(CO32-)+c(HCO3-)=0.2mol•L-1.
| 溶质 | NaHCO3 | Na2CO3 | NaF | NaClO |
| pH | 8.4 | 11.6 | 7.5 | 9.7 |
(2)根据盐溶液的pH,可知①Ka(HClO) ②Ka1(H2CO3) ③Ka(HF) ④Ka2(H2CO3)的大小顺序为③②①④.
(3)将少量CO2通入NaClO溶液中,写出该反应的离子方程式:CO2+H2O+ClO-=HClO+HCO3-.
(4)将CO2通入0.1mol•L-1的Na2CO3溶液中至中性,则溶液中2c(CO32-)+c(HCO3-)=0.2mol•L-1.
11.对任何一个平衡体系采用以下措施,速率改变但平衡一定不移动的是( )
| A. | 加入一种反应物 | B. | 升高温度 | ||
| C. | 对平衡体系增加压强 | D. | 使用催化剂 |
18.工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2.在该反应中( )
| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1molNa2S2O3,转移4mol电子 | |
| D. | 该化学离子方程式:CO32-+2S2-+4SO2═3S2O32-+CO2 |
15.下列实验能达到预期目的是( )
| A. | 检验溶液中是否含有I-:加入CCl4,CCl4层显紫色 | |
| B. | 检验溶液中是否含有SO42-:先滴加稀硝酸,再滴加BaCl2溶液 | |
| C. | 检验溶液中是否含有CO32-:滴加稀盐酸,将产生的气体通入澄清石灰水 | |
| D. | 检验溶液中是否含有S2-:滴加硫酸铜溶液,出现黑色沉淀 |
16.下列说法正确的是( )
| A. | 18gD2O中含有的中子数为10 NA(设NA为阿伏加德罗常数的数值) | |
| B. | 电解精炼铜时,每转移1mol电子,阳极溶解铜的质量为32g | |
| C. | 恒温恒容下,某可逆反应X(g)+Y(g)?Z(g)+W(s)△H>0达平衡后再加入X,该反应的△H增大 | |
| D. | 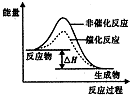 如图表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |