题目内容
氮有多种化合价,能形成多种化合物.工业上用活性炭还原法处理NO,有关反应为:C(s)+2NO(g)?N2(g)+CO2(g).向密闭的2L容器中,加入NO和足量的活性炭,恒温条件下反应.
(1)若2min内气体密度增大了1.2g/L,则氮气的平均反应速率为 mol/(L?min).
(2)该化学平衡常数表达式K= ,已知升高温度时,K增大,则正反应为 (填“吸热”或“放热”)反应.
(3)在温度不变的情况下,要提高NO的平衡转化率,可以采取的措施是 .
(4)下列各项能判断该反应达到平衡的是 (填序号字母).
a.容器内压强保持不变 b.2v正(NO)=v逆(N2)
c.容器内CO2的体积分数不变 d.混合气体的密度保持不变
(5)已知NaNO2溶液呈碱性,则NaNO2溶液中离子浓度由大到小的顺序是 .
(6)常温下,NaOH溶液和HNO2溶液等体积混合后,所得溶液的pH=7,下列关系正确的是 .
a.c(Na+)>c(NO2-) b.c(Na+)=c(NO2-)
c.c(Na+)<c(NO2-) d.c(Na+)>c(OH-)
(1)若2min内气体密度增大了1.2g/L,则氮气的平均反应速率为
(2)该化学平衡常数表达式K=
(3)在温度不变的情况下,要提高NO的平衡转化率,可以采取的措施是
(4)下列各项能判断该反应达到平衡的是
a.容器内压强保持不变 b.2v正(NO)=v逆(N2)
c.容器内CO2的体积分数不变 d.混合气体的密度保持不变
(5)已知NaNO2溶液呈碱性,则NaNO2溶液中离子浓度由大到小的顺序是
(6)常温下,NaOH溶液和HNO2溶液等体积混合后,所得溶液的pH=7,下列关系正确的是
a.c(Na+)>c(NO2-) b.c(Na+)=c(NO2-)
c.c(Na+)<c(NO2-) d.c(Na+)>c(OH-)
考点:化学平衡的影响因素,反应速率的定量表示方法,化学平衡常数的含义,化学平衡状态的判断,酸碱混合时的定性判断及有关ph的计算
专题:化学平衡专题
分析:(1)气体密度增大了1.2g/L,可以计算出固体C的质量减小了2.4g,可以计算氮气的物质的量的变化量,进而计算反应速率;
(2)化学平衡常数K=
,对于吸热反应,温度升高,K增大;
(3)在温度不变的情况下,要提高NO的平衡转化率,只要是化学平衡正向移动即可;
(4)达到化学平衡状态时,正逆反应速率相等,各个组分的浓度不变,据此回答判断;
(5)NaNO2溶液呈碱性,是因为亚硝酸根离子水解导致的,据此回答;
(6)根据溶液中的电荷守恒以及离子浓度的大小关系来判断.
(2)化学平衡常数K=
| 各个生成物平衡浓度系数次方的乘积 |
| 各个反应物平衡浓度系数次方的乘积 |
(3)在温度不变的情况下,要提高NO的平衡转化率,只要是化学平衡正向移动即可;
(4)达到化学平衡状态时,正逆反应速率相等,各个组分的浓度不变,据此回答判断;
(5)NaNO2溶液呈碱性,是因为亚硝酸根离子水解导致的,据此回答;
(6)根据溶液中的电荷守恒以及离子浓度的大小关系来判断.
解答:
解:(1)根据题意,气体密度增大了1.2g/L,计算出固体C的质量减小了2.4g,则生成氮气的物质的量是
=0.2mol,所以氮气表示的反应速率v=
=
=0.05mol/(L?min),故答案为:0.05;
(2)化学平衡常数K=
=
,温度升高,K增大,则该反应是吸热反应,故答案为:
;吸热;
(3)在温度不变的情况下,减小产物的浓度可以让平衡争相与移动,从而提高NO的平衡转化率,故答案为:移走生成物N2和(或)CO2;
(4)a.该反应是前后系数和相等的反应,当容器内压强保持不变,不一定平衡,故a错误;
b.2v正(NO)=v逆(N2),不能证明正逆反应速率相等,故b错误;
c.容器内CO2的体积分数不变,证明达到了平衡,故c正确;
d.混合气体的密度ρ=
,质量是变化的,V不变,所以当密度保持不变,证明达到了平衡,故d正确.
故选cd;
(5)NaNO2溶液呈碱性,c(OH-)>c(H+),是因为亚硝酸根离子水解导致的,所以c(Na+)>c(NO2-),即c(Na+)>c(NO2-)>c(OH-)>c(H+),故答案为:c(Na+)>c(NO2-)>c(OH-)>c(H+);
(6)NaOH溶液和HNO2溶液等体积混合后,所得溶液的pH=7,则c(OH-)=c(H+),根据电荷守恒,则c(Na+)=c(NO2-),离子浓度关系是:c(Na+)=c(NO2-)>c(OH-)=c(H+),所以c(Na+)>c(OH-),故答案为:bd.
| 2.4g |
| 12g/mol |
| △c |
| △t |
| ||
| 2min |
(2)化学平衡常数K=
| 各个生成物平衡浓度系数次方的乘积 |
| 各个反应物平衡浓度系数次方的乘积 |
| c(CO2)?c(N2) |
| c2(NO) |
| c(CO2)?c(N2) |
| c2(NO) |
(3)在温度不变的情况下,减小产物的浓度可以让平衡争相与移动,从而提高NO的平衡转化率,故答案为:移走生成物N2和(或)CO2;
(4)a.该反应是前后系数和相等的反应,当容器内压强保持不变,不一定平衡,故a错误;
b.2v正(NO)=v逆(N2),不能证明正逆反应速率相等,故b错误;
c.容器内CO2的体积分数不变,证明达到了平衡,故c正确;
d.混合气体的密度ρ=
| m |
| V |
故选cd;
(5)NaNO2溶液呈碱性,c(OH-)>c(H+),是因为亚硝酸根离子水解导致的,所以c(Na+)>c(NO2-),即c(Na+)>c(NO2-)>c(OH-)>c(H+),故答案为:c(Na+)>c(NO2-)>c(OH-)>c(H+);
(6)NaOH溶液和HNO2溶液等体积混合后,所得溶液的pH=7,则c(OH-)=c(H+),根据电荷守恒,则c(Na+)=c(NO2-),离子浓度关系是:c(Na+)=c(NO2-)>c(OH-)=c(H+),所以c(Na+)>c(OH-),故答案为:bd.
点评:本题综合考查学生化学反应速率的计算、化学平衡的移动、平衡状态的判断以及溶液中离子浓度大小关系等知识,注意知识的归纳和整理是关键,难度不大.

练习册系列答案
相关题目
具有解热镇痛作用的阿斯匹林的结构式为: ,在适宜的条件下阿斯匹林可能发生的反应是
,在适宜的条件下阿斯匹林可能发生的反应是
①?消去反应;②?酯化反应;?③银镜反应;④?加成反应;?⑤水解反应;?⑥中和反应( )
 ,在适宜的条件下阿斯匹林可能发生的反应是
,在适宜的条件下阿斯匹林可能发生的反应是①?消去反应;②?酯化反应;?③银镜反应;④?加成反应;?⑤水解反应;?⑥中和反应( )
| A、????①②③④ |
| B、???①③⑤⑥ |
| C、???②③④⑤ |
| D、???②④⑤⑥ |
一定条件下,反应A2(g)+B2(g)═2AB(g)达到平衡的标志是( )
| A、单位时间内生成1mol A2同时生成1mol AB |
| B、单位时间内生成2mol AB同时生成1mol B2 |
| C、单位时间内生成1mol A2同时生成1mol B2 |
| D、单位时间内生成1mol A2同时消耗1mol B2 |
某有机物的结构简式为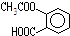 ,它可以发生的反应类型有( )
,它可以发生的反应类型有( )
①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥中和 ⑦缩聚 ⑧加聚.
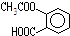 ,它可以发生的反应类型有( )
,它可以发生的反应类型有( )①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥中和 ⑦缩聚 ⑧加聚.
| A、只有①②④⑤ |
| B、只有①②④⑤⑥ |
| C、只有①②④⑤⑥⑦ |
| D、只有①②④⑤⑥⑧ |
 某实验小组为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.
某实验小组为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.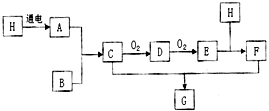 已知图中H是常见无色液体,B是空气中含量最多的物质,A和B要在高温高压才能合成C,F是一种强酸:
已知图中H是常见无色液体,B是空气中含量最多的物质,A和B要在高温高压才能合成C,F是一种强酸: