题目内容
19.合金与纯金属性能为何不同?分析 金属材料包含着合金和金属,合金是由一种金属与其它一种或几种金属(或非金属)一起熔合而成的具有金属特性的物质.合金与其成分金属相比,其硬度、强度和机械性能强于成分金属,熔点低于成分金属.
解答 解:合金相对于组成它的金属来说,一般具有颜色更多样、密度较小、熔点较低、耐腐蚀性强、硬度大、机械强度大等方面的特点.
答:合金与纯金属性能为何不同,主要有颜色多样;硬度大;熔点低;耐腐蚀性强.
点评 本题主要考查合金的性质,掌握合金的性质是正确解决该题的关键,题目难度不大.

练习册系列答案
相关题目
7.下列陈述Ⅰ和Ⅱ均正确,并存在因果关系的是( )
| 陈述Ⅰ | 陈述Ⅱ | |
| A | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| B | 非金属性:Cl>S | 酸性:HClO3>H2SO4 |
| C | 常温下,NaHCO3的溶解度比Na2CO3小 | 向饱和Na2CO3溶液中通入CO2产生沉淀 |
| D | 常温下,SO2与氢硫酸和NaOH溶液均可反应 | SO2是两性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
11.下列各组物质中,所含分子数一定相同的是( )
| A. | lgH2 和 8gO2 | |
| B. | 150℃、1.01×105Pa 时,18LH2O和 18LCO2 | |
| C. | 0.1 molHCl和2.24LHe | |
| D. | 标准状况下,2.24LCCl4和6.02×1022个CO分子 |
8.下列各组中的离子,能在溶液中大量共存的是( )
| A. | Fe3+、Na+、Cl-、OH- | B. | Fe3+、Cl-、K+、Ca2+ | ||
| C. | Cl-、Ca2+、Mg2+、CO32- | D. | Ba2+、K+、CO32-、Cl- |
9.按要求写出方程式.
(1)碳酸氢铵溶液中加入过NaOH溶液,并加热(写出离子方量程式)NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO32-+2H2O.
(2)已知4℃时四种化合物在水中和液氨中的溶解度如表:
上述四种物质在水中形成复分解反应的离子方程式为Ag++Cl-=AgCl↓,在液氨中发生复分解反应的化学方程式为Ba(NO3)+2AgCl=2AgNO3+BaCl2↓.
(1)碳酸氢铵溶液中加入过NaOH溶液,并加热(写出离子方量程式)NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO32-+2H2O.
(2)已知4℃时四种化合物在水中和液氨中的溶解度如表:
| AgNO3 | Ba(NO3)2 | AgCl | BaC12 | |
| H2O (液) | 170g | 9.2g | 1.5×10-4g | 33.3g |
| NH3(液) | 86g | 97.2g | 0.8g | 0g |

 .
.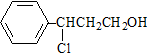 $→_{△}^{O_{2}/Cu}$$→_{Ⅱ}^{一定条件}$乙
$→_{△}^{O_{2}/Cu}$$→_{Ⅱ}^{一定条件}$乙 ,设计步骤Ⅰ的目的是保护碳碳双键,防止被氧化.
,设计步骤Ⅰ的目的是保护碳碳双键,防止被氧化.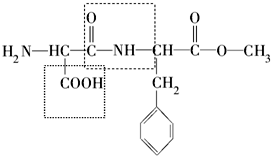 为纪念化学学科所取得的成就以及对人类文明的贡献,联合国将2011年定为“国际化学年”,其主题为“化学──我们的生活,我们的未来”.化学关注食品安全、人类健康和社会的可持续发展,为改善人类生活质量、提高人类生活水平发挥了重要作用.请回答下列问题:
为纪念化学学科所取得的成就以及对人类文明的贡献,联合国将2011年定为“国际化学年”,其主题为“化学──我们的生活,我们的未来”.化学关注食品安全、人类健康和社会的可持续发展,为改善人类生活质量、提高人类生活水平发挥了重要作用.请回答下列问题: