题目内容
10.设NA为阿伏伽徳罗常数的值.下列有关叙述错误的是( )| A. | 100g质量分数为46%的乙醇水溶液中氧原子数为4NA | |
| B. | lmolCl2通入水中,HC1O、Cl-、ClO-粒子数之和等于2NA | |
| C. | 标准状况下,2.24LD2中所含中子的数目是0.2NA | |
| D. | 25°C时,Ksp(BaSO4)=1×10-10,则 BaSO4饱和溶液中Ba2+浓度为 l×10-5mol•L-1 |
分析 A、乙醇溶液中,除了乙醇,水也含氧原子;
B、氯气和水的反应为可逆反应;
C、求出重氢的物质的量,然后根据重氢中含2个中子来分析;
D、BaSO4饱和溶液中c(Ba2+)•c(SO42-)=Ksp(BaSO4)=1×10-10,且c(Ba2+)=c(SO42-).
解答 解:A、乙醇溶液中,除了乙醇,水也含氧原子,而100g质量分数为46%的乙醇溶液中,含有的乙醇的物质的量为n=$\frac{100g×46%}{46g/mol}$=1mol,其中含1mol氧原子;而含有的水的物质的量为n=$\frac{100g-46g}{18g/mol}$=3mol,其中含3mol氧原子,故共含4mol氧原子即4NA个,故A正确;
B、氯气和水的反应为可逆反应,不能进行彻底,溶液中含未反应的氯气分子,故溶液中的HC1O、Cl-、ClO-粒子数之和小于2NA,故B错误;
C、标况下2.24L重氢的物质的量为0.1mol,而重氢中含2个中子,故0.1mol重氢中含0.2NA个中子,故C正确;
D、BaSO4饱和溶液中c(Ba2+)•c(SO42-)=Ksp(BaSO4)=1×10-10,且c(Ba2+)=c(SO42-),故有c(Ba2+)2=Ksp(BaSO4)=1×10-10,则c(Ba2+)=1×10-5mol/L,故D正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
6.化学是一门实用性很强的科学,与社会、环境等密切相关.下列说法错误的是( )
| A. | “静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量 | |
| B. | 雾霾可能是许多细小液体小液滴和固体小颗粒分散到空气中形成的一种胶体 | |
| C. | 铝制餐具不宜用来蒸煮或长时间存放咸的食品 | |
| D. | 在食品袋中放入CaCl2•6H2O,可防止食物受潮 |
15.下列说法正确的是( )
| A. | 为了防止富脂食品氧化变质,延长食品的保质期,常在包装袋中放入生石灰 | |
| B. | 实验室用带玻璃塞的试剂瓶保存氢氧化钠溶液 | |
| C. | 工业生产玻璃、水泥、漂白粉,均需要用石灰石为原料 | |
| D. | 可以利用氯化铁溶液的酸性清除铜镜表面的铜锈 |
2.化学与生产、生活紧密相关,下列物质的性质和用途均正确且有因果关系的是( )
| 选项 | 性质 | 用途 |
| A | 糖类、油脂和蛋白质均能水解 | 供给人类营养 |
| B | 铁能被浓硫酸钝化 | 铁制器皿用作铜和浓硫酸的反应容器 |
| C | 碳单质的还原性强于硅单质 | 碳与石英反应冶炼粗硅 |
| D | 常温下,氨气能与氯气反应 | 浓氨水检验氯气管道泄漏 |
| A. | A | B. | B | C. | C | D. | D |
1.水煤气法制甲醇工艺流程框图如图:
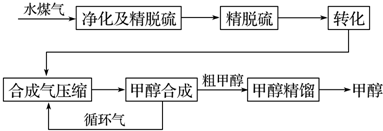
已知:除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成.
(1)制水煤气的主要化学反应方程式为C(s)+H2O(g)?CO(g)+H2(g),此反应是吸热反应.
①此反应的化学平衡常数表达式为$\frac{[CO]•[{H}_{2}]}{[{H}_{2}O]}$;
②下列能提高碳的平衡转化率的措施是BC.
A加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为CH4(g)+$\frac{3}{2}$O2(g)?CO(g)+2H2O(g)△H=-519kJ.工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同).
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是Z(填“X”或“Y”或“Z”),选择的理由是催化活性高、速度快、反应温度较低.
(3)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g)+CO(g)?CH3OH(g)△H=-181.6kJ.4℃下此反应的平衡常数为160.此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v正>v逆(填“>”、“<”或“=”).
②若加入同样多的CO、H2,在T5℃反应,10min后达到平衡,此时c(H2)=0.4mol•L-1,则该时间内反应速率v(CH3OH)=0.03mol•L-1•min-1.
(4)生产过程中,合成气要进行循环,其目的是提高原料利用率(或提高产量、产率亦可).

已知:除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成.
(1)制水煤气的主要化学反应方程式为C(s)+H2O(g)?CO(g)+H2(g),此反应是吸热反应.
①此反应的化学平衡常数表达式为$\frac{[CO]•[{H}_{2}]}{[{H}_{2}O]}$;
②下列能提高碳的平衡转化率的措施是BC.
A加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为CH4(g)+$\frac{3}{2}$O2(g)?CO(g)+2H2O(g)△H=-519kJ.工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同).
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是Z(填“X”或“Y”或“Z”),选择的理由是催化活性高、速度快、反应温度较低.
(3)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g)+CO(g)?CH3OH(g)△H=-181.6kJ.4℃下此反应的平衡常数为160.此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/mol•L-1 | 0.2 | 0.1 | 0.4 |
②若加入同样多的CO、H2,在T5℃反应,10min后达到平衡,此时c(H2)=0.4mol•L-1,则该时间内反应速率v(CH3OH)=0.03mol•L-1•min-1.
(4)生产过程中,合成气要进行循环,其目的是提高原料利用率(或提高产量、产率亦可).
 磷及其化合物在生产生活中的用途非常广泛.回答下列问题:
磷及其化合物在生产生活中的用途非常广泛.回答下列问题:
 +
+ $\stackrel{△}{→}$
$\stackrel{△}{→}$
 b.
b. c.
c.
 .
. .
. .
. ,写出其合成路线:
,写出其合成路线: .
.