题目内容
(1)常温下,用pH试纸测得碳酸钠溶液的pH为10,简述测定该溶液的pH的操作方法是: 向溶液中滴入几滴酚酞试液,溶液呈红色,用离子方程式表示其原因:
(2)将硫酸铝溶液和碳酸氢钠溶液混合,可观察到的现象是生成无色气体和絮状沉淀,写出该反应的离子方程式:
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 .
(2)将硫酸铝溶液和碳酸氢钠溶液混合,可观察到的现象是生成无色气体和絮状沉淀,写出该反应的离子方程式:
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的
考点:试纸的使用,盐类水解的应用
专题:盐类的水解专题,化学实验基本操作
分析:(1)碳酸钠中碳酸根离子结合水电离的氢离子,促成了水的电离;把一小块pH试纸放在表面皿(或玻璃片)上,用蘸有Na2CO3溶液的玻璃棒点在试纸的中部,试纸变色后与标准比色卡比较;
(2)铝离子水解显酸性,碳酸氢根离子水解显碱性,混合后水解相互促进生成氢氧化铝和二氧化碳;
(3)硫化钠为强碱弱酸盐,在溶液中存在水解平衡,从平衡移动的角度分析并解答该题.
(2)铝离子水解显酸性,碳酸氢根离子水解显碱性,混合后水解相互促进生成氢氧化铝和二氧化碳;
(3)硫化钠为强碱弱酸盐,在溶液中存在水解平衡,从平衡移动的角度分析并解答该题.
解答:
解:(1)把一小块pH试纸放在表面皿(或玻璃片)上,用蘸有Na2CO3溶液的玻璃棒点在试纸的中部,试纸变色后与标准比色卡比较;碳酸钠溶液中碳酸根离子水解,促进了水的电离,溶液中氢氧根离子浓度大于氢离子,溶液显示碱性,反应的离子方程式为:CO32-+H2O?HCO3-+OH-,
故答案为:把一小块pH试纸放在表面皿(或玻璃片)上,用蘸有Na2CO3溶液的玻璃棒点在试纸的中部,试纸变色后与标准比色卡比较,确定溶液的pH;CO32-+H2O?HCO3-+OH-;
(2)铝离子水解显酸性,碳酸氢根离子水解显碱性,混合后水解相互促进生成氢氧化铝和二氧化碳,反应的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(3)硫化钠为强碱弱酸盐,在溶液中存在水解平衡:S2-+H2O?HS-+OH-,为了防止发生水解,可以加入少量NaOH,使平衡向逆反应方向移动,从而抑制水解,
故答案为:NaOH.
故答案为:把一小块pH试纸放在表面皿(或玻璃片)上,用蘸有Na2CO3溶液的玻璃棒点在试纸的中部,试纸变色后与标准比色卡比较,确定溶液的pH;CO32-+H2O?HCO3-+OH-;
(2)铝离子水解显酸性,碳酸氢根离子水解显碱性,混合后水解相互促进生成氢氧化铝和二氧化碳,反应的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(3)硫化钠为强碱弱酸盐,在溶液中存在水解平衡:S2-+H2O?HS-+OH-,为了防止发生水解,可以加入少量NaOH,使平衡向逆反应方向移动,从而抑制水解,
故答案为:NaOH.
点评:本题考查盐类的水解,题目难度不大,注意水解平衡移动的影响因素.

练习册系列答案
相关题目
下列说法正确的是( )
| A、第ⅠA族金属单质的密度、熔沸点均随着核电荷数的增大而递增 |
| B、金属锂在氧气中燃烧生成Li2 O2 |
| C、金属的还原性:Li>Na>K>Rb |
| D、氢化物的稳定性:HF>HCl>HBr>HI |
下列有关碱金属铷(Rb)的叙述中,正确的是( )
| A、灼烧氯化铷时,火焰有特殊颜色 |
| B、硝酸铷是离子化合物,不易溶于水 |
| C、在钠、钾、铷三种单质中,铷的熔点最高 |
| D、氢氧化铷是弱碱 |
下列化合物中,化学键的类型和分子的极性(极性或非极性)皆相同的是( )
| A、CO2和SO2 |
| B、CH4和SiO2 |
| C、BF3和NH3 |
| D、HCl和HI |
实验室用铅蓄电池作电源电解饱和食盐水制取氯气.已知铅蓄电池放电时发生如下反应:
负极:Pb+SO42--2e-=PbSO4 正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
今若制取0.25mol Cl2,这时电池内消耗的H2SO4的物质的量至少是( )
负极:Pb+SO42--2e-=PbSO4 正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
今若制取0.25mol Cl2,这时电池内消耗的H2SO4的物质的量至少是( )
| A、0.25 mol |
| B、0.35 mol |
| C、0.50mol |
| D、0.75mol |
 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的含两种元素的化合物.
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的含两种元素的化合物.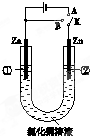 在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按图连接.
在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按图连接. NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,反应的化学方程式为2CO+2NO?N2+2CO2△H<0
NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,反应的化学方程式为2CO+2NO?N2+2CO2△H<0