��Ŀ����
 ������ȼ��ʱ�ܷų��������ȣ���Ҳ��Һ��ʯ��������Ҫ�ɷ֣���Ϊ��ԴӦ�������ǵ��ճ����������
������ȼ��ʱ�ܷų��������ȣ���Ҳ��Һ��ʯ��������Ҫ�ɷ֣���Ϊ��ԴӦ�������ǵ��ճ������������֪����2C3H8��g��+7O2��g���T6CO��g��+8H2O��l����H=-2741.8kJ/mol
��2CO��g��+O2��g���T2CO2��g����H=-566kJ/mol
��1����ӦC3H8��g��+5O2��g���T3CO2��g��+4H2O��l���ġ�H=
��2��C3H8�ڲ�������������ȼ�գ�����CO��CO2�Լ���̬ˮ�������еIJ���ͨ��һ������̶����ܱ������У���һ�������·������¿��淴Ӧ��CO��g��+H2O��g��?CO2��g��+H2��g������H��0��ij�¶��£��ڼס������������ܱ������У���ʼʱ�����±����ݽ���Ͷ�ϣ���800��ʱ�ﵽƽ��״̬��K=1.0��
| H2O | CO | CO2 | H2 | |
| ��n/mol | 0.10 | 0.30 | 0.10 | 0.50 |
| ��n/mol | 0.20 | 0.20 | 0 | 0 |
����ͼ��ʾ������Ӧ��t1ʱ�̴ﵽƽ�⣬��t2ʱ����ı�ij�������������仯���������t2ʱ�̷����ı������������
��3��CO2����NaOH��Һ���յõ�Na2CO3��NaHCO3��
��Na2CO3��Һ������Ũ���ɴ�С��˳��Ϊ
����֪25��ʱ��Na2CO3��Һ��ˮ�ⳣ��ΪKb=2��10-4 mol?L-1������Һ��c��HCO3-����c��CO32-��=2��1ʱ��������Һ��pH=
��4������̼����ȼ�ϵ�أ�MCFS��������ú����CO+H2��������ȼ����������CO2�Ļ����Ϊ������ȼ������һ��������Li2CO3��Na2CO3���۵�����������ʣ��Խ�������ȼ�ϼ���Ϊ�����Ƴɵģ������ĵ缫��ӦʽΪ��
���㣺�Ȼ�ѧ����ʽ,������ѧ��Դ�����༰�乤��ԭ��,���ʵ�����Ũ����ʱ��ı仯����,����ˮ���Ӧ��
ר�⣺�����������������
��������1�������Ȼ�ѧ����ʽ��˹���ɼ���õ������Ȼ�ѧ����ʽ��
��2��������ͼ�������ݼ������ʵ�������Ӧǰ�����ʵļ���������1�����������ʵ�������Ũ�ȼ���Ũ���̣���ƽ�ⳣ�����бȽϷ����ж�ȡֵ�����ƽ������ʽ��ƽ�ⳣ����ʽ������������һ����̼��ת���ʣ�
��t2ʱƽ��������Ӧ�����ƶ���
��3����̼������Һ��̼������ӷֲ�ˮ�⣬��Һ�ʼ��ԣ�
������ˮ��ƽ�ⳣ���͵���ƽ�ⳣ��������Һ��pH��
��4��CO��H2���л�ԭ�ԣ��ڸ����Ϸ���������Ӧ����CO2��H2O���������������ԣ��������Ϸ�����ԭ��Ӧ����ϵ������д�缫��Ӧʽ��
��2��������ͼ�������ݼ������ʵ�������Ӧǰ�����ʵļ���������1�����������ʵ�������Ũ�ȼ���Ũ���̣���ƽ�ⳣ�����бȽϷ����ж�ȡֵ�����ƽ������ʽ��ƽ�ⳣ����ʽ������������һ����̼��ת���ʣ�
��t2ʱƽ��������Ӧ�����ƶ���
��3����̼������Һ��̼������ӷֲ�ˮ�⣬��Һ�ʼ��ԣ�
������ˮ��ƽ�ⳣ���͵���ƽ�ⳣ��������Һ��pH��
��4��CO��H2���л�ԭ�ԣ��ڸ����Ϸ���������Ӧ����CO2��H2O���������������ԣ��������Ϸ�����ԭ��Ӧ����ϵ������д�缫��Ӧʽ��
���
�⣺��1����֪��2C3H8��g��+7O2��g���T6CO��g��+8H2O��g����H=-2389.8kJ/mol
��2CO��g��+O2��g���T2CO2��g����H=-566kJ/mol
��H2O��l���TH2O��g����H=+44.0kJ/mol
���ݸ�˹���ɢ�+�ڡ�3-�ۡ�8�õ�2C3H8��g��+10O2��g���T6CO2��g��+8H2O��l����H=-4439.8kJ/mol��
�ʴ�Ϊ��C3H8��g��+5O2��g���T3CO2��g��+4H2O��l����H=-2219.9 kJ/mol��
��2������ʼʱ��������Ũ����Qc=
=1.66��1����Qc��K=1����Ӧ���淴Ӧ������У�
��������n��CO��=
=0.1mol��n��H2O��=
=0.1mol�����ݻ�ѧƽ������ʽ��ʽ���㣬��һ����̼���ĵ����ʵ���Ϊx���÷�Ӧǰ�����ʵļ���������1�����������ʵ�������Ũ�ȼ���ƽ�ⳣ����
CO��g��+H2O��g��?CO2��g��+H2��g��
��ʼ����mol�� 0.1 0.1 0 0
�仯����mol�� x x x x
ƽ������mol�� 0.1-x 0.1-x x x
K=
=1������x=0.05mol��
һ����̼ת����=
��100%=50%
�ʴ�Ϊ���淴Ӧ��50%��
��t2ʱƽ��������Ӧ�����ƶ���������̼Ũ������һ����̼Ũ�ȼ�С����Ӧ�Ƿ��ȷ�Ӧ�ɼ����¶�ʹƽ��������У�����������Ũ�Ȼ�����ˮ������Ũ����ʵ�ַ�Ӧ��ת����ϵ��
�ʴ�Ϊ�������¶ȣ�����H2Ũ�ȡ�����H2O��g��Ũ�ȣ�
��3����̼������Һ��̼�������ˮ�⣬CO32-+H2O?HCO3-+OH-��HCO3-+H2O?H2CO3+OH-����Һ������Ũ�ȴ�СΪc��Na+����c��CO32-����c��OH-����c��HCO3-����c��H+����
�ʴ�Ϊ��c��Na+����c��CO32-����c��OH-����c��HCO3-����c��H+����
��Kb=
=2��10-4����c��HCO3-����c��CO32-��=2��1����c��OH-��=10-4�����KW=10-14���ɵ�c��H+��=10-10��pH=10���ʴ�Ϊ��10��
��4����CO��H2���л�ԭ�ԣ��ڸ����Ϸ���������Ӧ����CO2��H2O���缫��ӦʽΪ��CO-2e-+CO32-�T2CO2��H2-2e-+CO32-�TCO2+H2O��
�ʴ�Ϊ��CO-2e-+CO32-�T2CO2��H2-2e-+CO32-�TCO2+H2O��
��2CO��g��+O2��g���T2CO2��g����H=-566kJ/mol
��H2O��l���TH2O��g����H=+44.0kJ/mol
���ݸ�˹���ɢ�+�ڡ�3-�ۡ�8�õ�2C3H8��g��+10O2��g���T6CO2��g��+8H2O��l����H=-4439.8kJ/mol��
�ʴ�Ϊ��C3H8��g��+5O2��g���T3CO2��g��+4H2O��l����H=-2219.9 kJ/mol��
��2������ʼʱ��������Ũ����Qc=
| 0.50��0.10 |
| 0.3����0.10 |
��������n��CO��=
| 2.8g |
| 28g/mol |
| 1.8g |
| 18g/mol |
CO��g��+H2O��g��?CO2��g��+H2��g��
��ʼ����mol�� 0.1 0.1 0 0
�仯����mol�� x x x x
ƽ������mol�� 0.1-x 0.1-x x x
K=
| x2 |
| (0.1-x)2 |
һ����̼ת����=
| 0.05mol |
| 0.1mol |
�ʴ�Ϊ���淴Ӧ��50%��
��t2ʱƽ��������Ӧ�����ƶ���������̼Ũ������һ����̼Ũ�ȼ�С����Ӧ�Ƿ��ȷ�Ӧ�ɼ����¶�ʹƽ��������У�����������Ũ�Ȼ�����ˮ������Ũ����ʵ�ַ�Ӧ��ת����ϵ��
�ʴ�Ϊ�������¶ȣ�����H2Ũ�ȡ�����H2O��g��Ũ�ȣ�
��3����̼������Һ��̼�������ˮ�⣬CO32-+H2O?HCO3-+OH-��HCO3-+H2O?H2CO3+OH-����Һ������Ũ�ȴ�СΪc��Na+����c��CO32-����c��OH-����c��HCO3-����c��H+����
�ʴ�Ϊ��c��Na+����c��CO32-����c��OH-����c��HCO3-����c��H+����
��Kb=
| c(HCO3-)?c(OH-) |
| c(CO32-) |
��4����CO��H2���л�ԭ�ԣ��ڸ����Ϸ���������Ӧ����CO2��H2O���缫��ӦʽΪ��CO-2e-+CO32-�T2CO2��H2-2e-+CO32-�TCO2+H2O��
�ʴ�Ϊ��CO-2e-+CO32-�T2CO2��H2-2e-+CO32-�TCO2+H2O��
���������⿼�����Ȼ�ѧ����ʽ��д��˹���ɼ���Ӧ�ã���ѧƽ�ⳣ��Ӱ�����غͼ��㣬��ѧƽ����㣬�������Һ�е���غ㣬�����غ�ļ���Ӧ���ǽ���ؼ�����Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
 ������ҵ����ν�����������ϵ�д�
������ҵ����ν�����������ϵ�д�
�����Ŀ
NAΪ����٤������������˵����ȷ���ǣ�������
| A��0.1mol?L-1��NaOH��Һ�У�����������Ϊ0.1NA |
| B����״���£�22.4L CHCl3�к���ԭ����Ϊ3NA |
| C��1mol Na2O2������������������ΪNA |
| D�������ʵ�����N2��CO�ķ�������ΪNA�� |
��ͬ���ʵ������ơ�þ�����������ϡ���ᷴӦ���ڱ���²���������������ǣ�������
| A��1��1��1 |
| B��1��2��3 |
| C��6��3��2 |
| D��23��24��27 |
���з�Ӧ�м��ǷֽⷴӦ������������ԭ��Ӧ���ǣ�������
A��C+O2
| ||||
B��CaCO3
| ||||
C��2KMnO4
| ||||
| D��Zn+H2SO4=ZnSO4+H2�� |
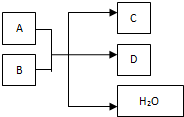 ��һ�������£�ijЩ��ѧ��Ӧ������ͼ��ʾ����ش���������
��һ�������£�ijЩ��ѧ��Ӧ������ͼ��ʾ����ش��������� ����ij��ȤС���ͬѧ����ͼ��ʾװ���о��йص绯ѧ�����⣮���պϸ�װ�õĵ��ʱ���۲쵽�����Ƶ�ָ�뷢����ƫת����ش��������⣺
����ij��ȤС���ͬѧ����ͼ��ʾװ���о��йص绯ѧ�����⣮���պϸ�װ�õĵ��ʱ���۲쵽�����Ƶ�ָ�뷢����ƫת����ش��������⣺